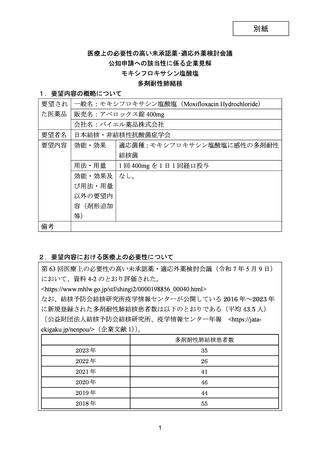
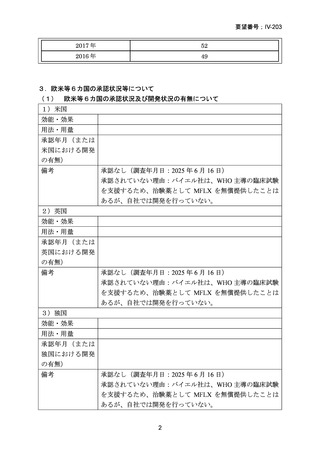
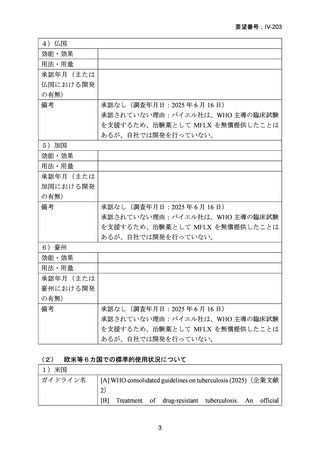
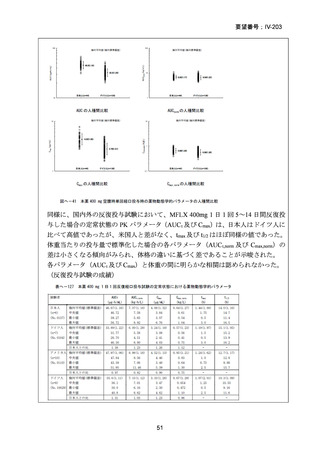
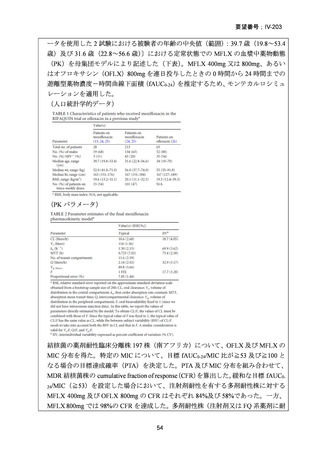
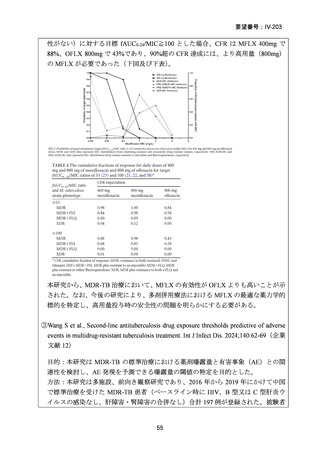
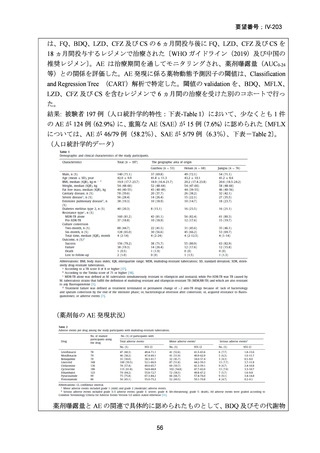
資料5-1 Ⅳ-203 モキシフロキサシン塩酸塩[15.1MB] (101 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
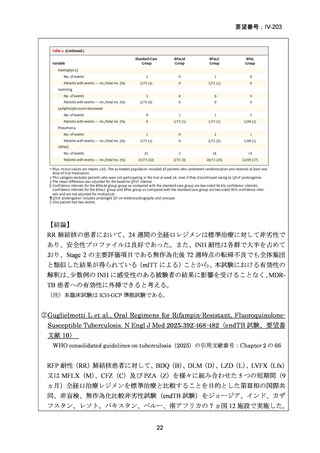
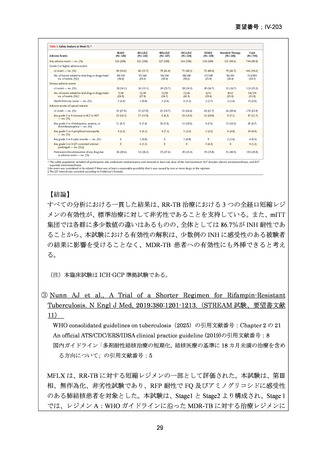
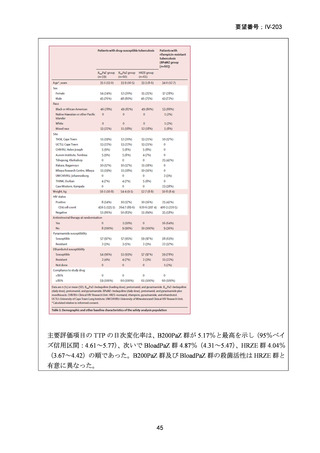
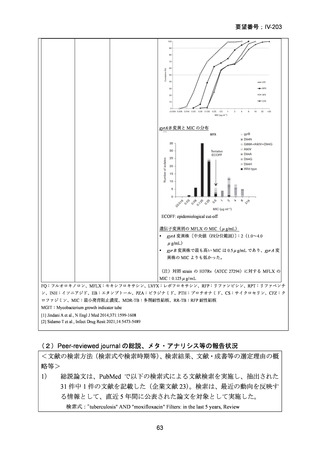
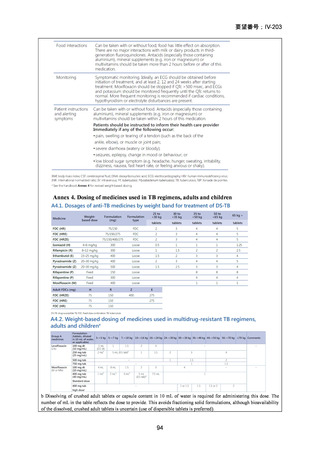
の 6 ヵ月投与)、BDQ の 6 ヵ月投与を含む 9 ヵ月全経口レジメン〔LVFX 又は MFLX
のいずれか、TH(LZD に置き換え可能)、EB、高用量 INH、PZA 及び CFZ を初期
4 ヵ月、その後に LVFX 又は MFLX のいずれか、CFZ、EB 及び PZA を継続投与〕
や BLMZ レジメン(BDQ、LZD、MFLX 及び PZA)が示されている。また、MDR/RRTB の長期レジメン(15~17 ヵ月又は 18~20 ヵ月)において、LVFX 又は MFLX を
必ず含めるべき薬剤(Group A)に分類している。2022 年版で推奨療法に含められ
た 6 ヵ月の BPaLM レジメンに続き、2025 年版では 9 ヵ月の BLMZ レジメンが推奨
療法として新たに追加されている。
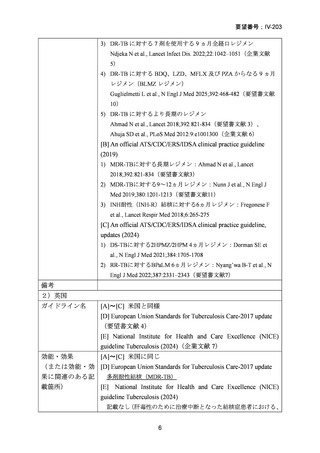
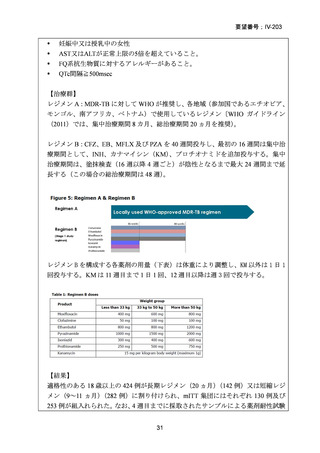
MDR-TB 治療のレジメンに LVFX 又は MFLX を含めるべきことは、米国胸部学
会(ATS)/米国疾病予防管理センター(CDC)/欧州呼吸器学会(ERS)/米国感染症
学会(IDSA)合同ガイドライン(2019)でも推奨されている。ATS/CDC/ERS/IDSA
合同ガイドラインは 2024 年(論文公表は 2025 年)に update されており、RR-TB に
対する BPaLM レジメンが推奨されている。
英国国際医療技術評価機構(NICE)ガイドライン(最新の更新は 2024 年)では、
活動性又は潜在性の結核患者、特に重症又は感染性が高い結核で有害事象のために
治療を中断した場合での処置の中で、肝毒性による場合であれば、肝毒性の低い抗
結核薬 2 剤以上〔FQ(LVFX 又は MFLX)の併用/非併用下で、EB 及び SM〕によ
る治療の継続を肝臓専門医の監視下で行うことが推奨されているが、FQ は適応外
使用であること、処方者は professional guidance を参照し、処方判断に責任を持つこ
とが示されている。
なお、国外ガイドラインの推奨内容は英原文のまま記載した。
1)
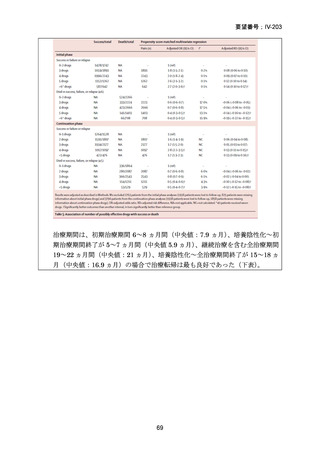
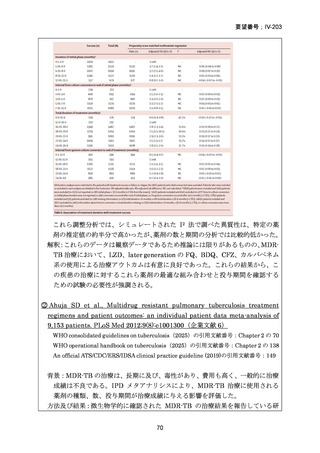
WHO consolidated guidelines on tuberculosis, Module 4: Treatment and care (2025)
〔WHO ガイドライン(企業文献 2)〕
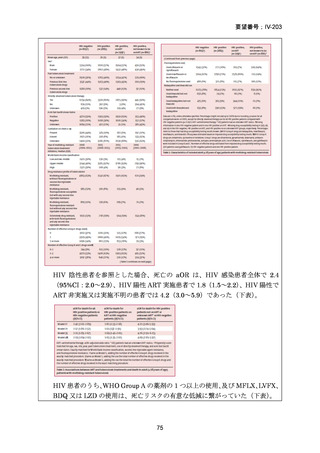
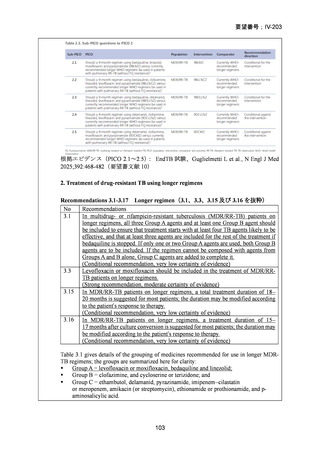
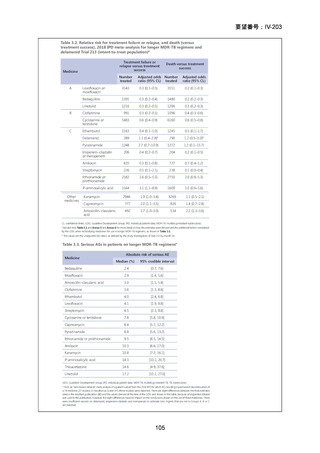
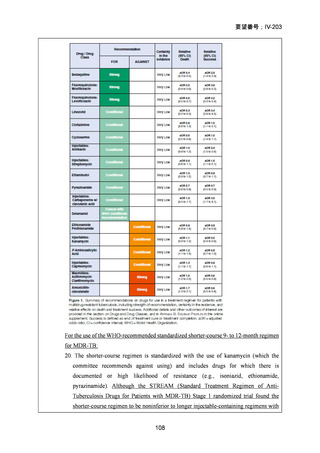
DR-TB 治療(Chapter 2)の推奨内容の一覧を示し、留意事項(remark)及び
根拠論文を以下に示す(MFLX 関連事項は赤枠で表示)。
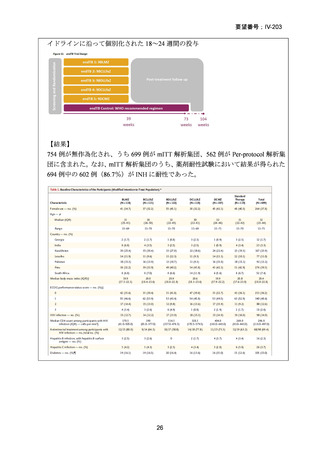
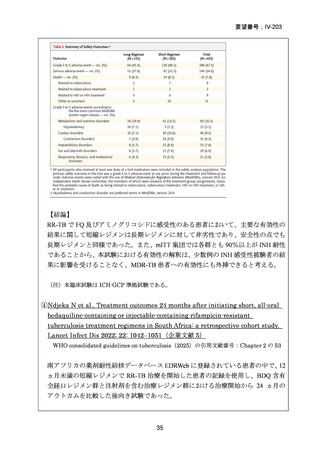
Chapter 2: Drug-resistant TB treatment
Table B. List of recommendations in the 2025 edition, where (a) is a new recommendation based on
review of the new evidence and (b) is a reprinted recommendation where no new evidence was
available or searched for the review
97