よむ、つかう、まなぶ。
【資料1-2】令和8年度研究事業実施方針(AMED研究)(案)の概要 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59644.html |
| 出典情報 | 厚生科学審議会 科学技術部会(第145回 7/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
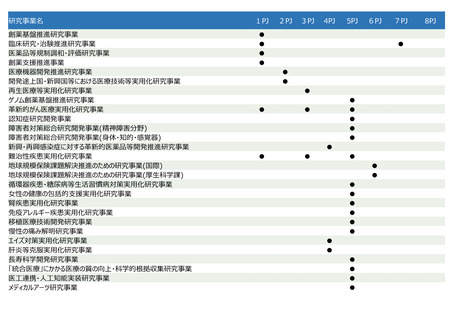
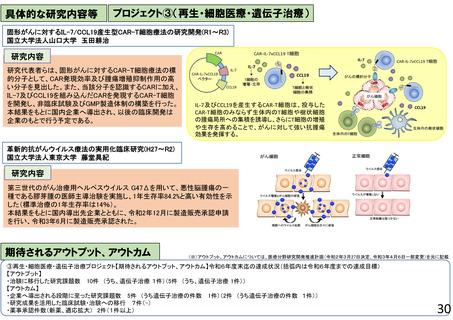
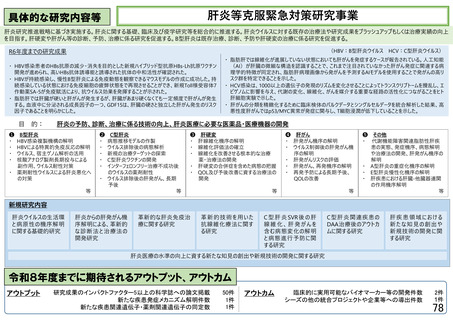
臨床研究・治験推進研究事業
事業概要(背景・目的)
令和7年度予算額
PJ区分
医薬品
医療機器・ヘルスケア
○ 有望な医薬品シーズがアカデミアや企業で見いだされても、その後の臨床研究や治験 再生・細胞医療・遺伝子治療
感染症
を効率的に実施しなければ、早期の薬事承認に繋がらない。
データ利活用・ライフコース
○ 日本で生み出された基礎研究の成果を薬事承認につなげ、革新的な医薬品を創出す シーズ開発・基礎研究
るため、科学性及び倫理性が十分に担保され得る質の高い臨床研究・治験を推進する。 橋渡し・臨床加速化
イノベーション・エコシステム
計
3,804,054千円
予算額(千円)
3,217,109
0
0
0
0
0
586,945
0
3,804,054
令和8年度概算要求のポイント
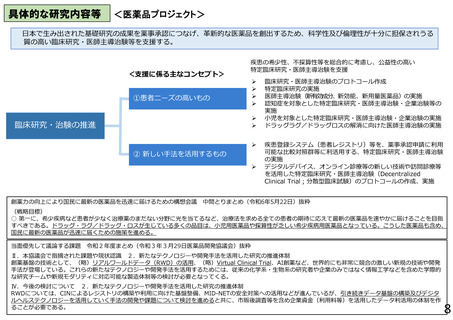
【医薬品プロジェクト】
○ 第三期の健康・医療戦略(令和7年2月18日閣議決定)において実用化の推進がキーワードとなっているなか、最も医薬品開発の出口に近い
臨床開発段階にある有望な課題を支援するため、本事業では多くの新規課題を採択することが必要である。
○ 日本で生み出された基礎研究の成果を薬事承認につなげ、革新的な医薬品を創出すべく、アカデミア主導の臨床研究・医師主導治験の支援
を促進している一方、現状の公募では採択数が限られており、有望な研究課題も不採択にせざるを得ない状況にあるため、採択課題数の増
加は必須である。(拡充)
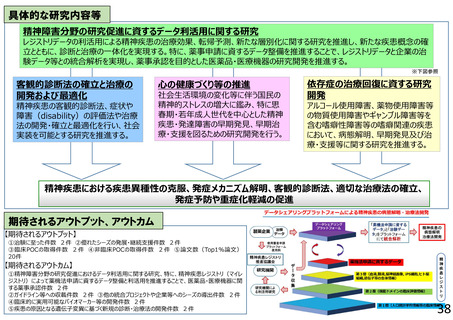
○ 革新的医薬品の開発は成功確率が低い一方で、開発コストは年々増加しているため、特に希少疾病や小児領域等で患者ニーズや社会的
ニーズは高いものの企業による開発が進みにくい領域において、引き続き臨床研究・治験等を推進する。
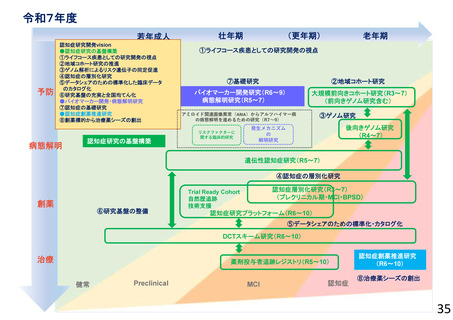
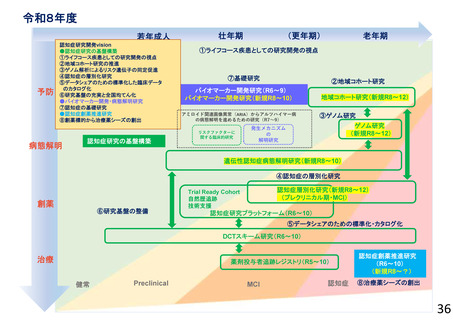
○ 喫緊の課題である認知症の克服に向けて、革新的な認知症治療薬の開発に取り組むべく、臨床研究・医師主導治験・企業治験等を推進する。
○ 疾患登録システム(患者レジストリ)等を、薬事承認申請に利用可能な比較対照群等に利活用する、特定臨床研究・医師主導治験を推進する。
〇 デジタルデバイス、オンライン診療等の新しい技術や訪問診療等を活用することで、被験者の安全性やデータの信頼性を担保しつつ、被験者
や関係者の負担を軽減し得る新しい手法(Decentralized Clinical Trial等)を活用した患者中心の臨床研究・医師主導治験を推進する。
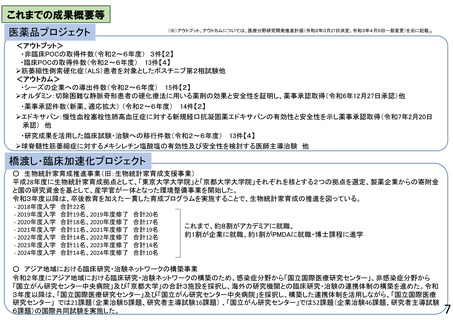
【橋渡し・臨床加速化プロジェクト】
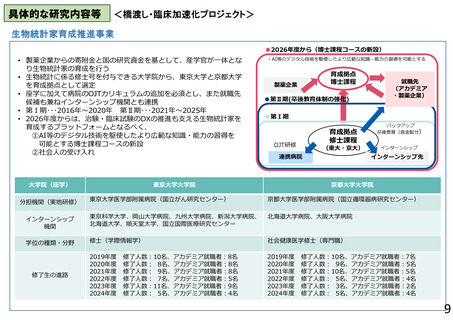
○ 生物統計家育成推進事業
製薬企業からの寄附金と国の研究資金を基とし、産学官が一体となって臨床研究・治験の質の向上に繋がる生物統計家の育成を行う。令和8
年度からは、臨床研究・治験DX推進も支える生物統計家育成のプラットフォームとするべく、社会人入学も受け入れた、AI等のデジタル技術を
駆使したより広範な知識・能力の習得を可能とする博士課程コースを新設し、実施体制のさらなる強化を図る。
○ アジア地域における臨床研究・治験ネットワークの構築事業
令和2年度第1次補正予算にて開始した「アジア地域における臨床研究・治験ネットワークの構築事業」において整備した基盤の継続性の確保、
臨床研究中核病院を中心とした国内における臨床研究支援人材育成強化、更なる拠点の整備を推進し、日本主導のアジア地域における国際
共同臨床研究・治験の実施体制の強化を図る。
6
事業概要(背景・目的)
令和7年度予算額
PJ区分
医薬品
医療機器・ヘルスケア
○ 有望な医薬品シーズがアカデミアや企業で見いだされても、その後の臨床研究や治験 再生・細胞医療・遺伝子治療
感染症
を効率的に実施しなければ、早期の薬事承認に繋がらない。
データ利活用・ライフコース
○ 日本で生み出された基礎研究の成果を薬事承認につなげ、革新的な医薬品を創出す シーズ開発・基礎研究
るため、科学性及び倫理性が十分に担保され得る質の高い臨床研究・治験を推進する。 橋渡し・臨床加速化
イノベーション・エコシステム
計
3,804,054千円
予算額(千円)
3,217,109
0
0
0
0
0
586,945
0
3,804,054
令和8年度概算要求のポイント
【医薬品プロジェクト】
○ 第三期の健康・医療戦略(令和7年2月18日閣議決定)において実用化の推進がキーワードとなっているなか、最も医薬品開発の出口に近い
臨床開発段階にある有望な課題を支援するため、本事業では多くの新規課題を採択することが必要である。
○ 日本で生み出された基礎研究の成果を薬事承認につなげ、革新的な医薬品を創出すべく、アカデミア主導の臨床研究・医師主導治験の支援
を促進している一方、現状の公募では採択数が限られており、有望な研究課題も不採択にせざるを得ない状況にあるため、採択課題数の増
加は必須である。(拡充)
○ 革新的医薬品の開発は成功確率が低い一方で、開発コストは年々増加しているため、特に希少疾病や小児領域等で患者ニーズや社会的
ニーズは高いものの企業による開発が進みにくい領域において、引き続き臨床研究・治験等を推進する。
○ 喫緊の課題である認知症の克服に向けて、革新的な認知症治療薬の開発に取り組むべく、臨床研究・医師主導治験・企業治験等を推進する。
○ 疾患登録システム(患者レジストリ)等を、薬事承認申請に利用可能な比較対照群等に利活用する、特定臨床研究・医師主導治験を推進する。
〇 デジタルデバイス、オンライン診療等の新しい技術や訪問診療等を活用することで、被験者の安全性やデータの信頼性を担保しつつ、被験者
や関係者の負担を軽減し得る新しい手法(Decentralized Clinical Trial等)を活用した患者中心の臨床研究・医師主導治験を推進する。
【橋渡し・臨床加速化プロジェクト】
○ 生物統計家育成推進事業
製薬企業からの寄附金と国の研究資金を基とし、産学官が一体となって臨床研究・治験の質の向上に繋がる生物統計家の育成を行う。令和8
年度からは、臨床研究・治験DX推進も支える生物統計家育成のプラットフォームとするべく、社会人入学も受け入れた、AI等のデジタル技術を
駆使したより広範な知識・能力の習得を可能とする博士課程コースを新設し、実施体制のさらなる強化を図る。
○ アジア地域における臨床研究・治験ネットワークの構築事業
令和2年度第1次補正予算にて開始した「アジア地域における臨床研究・治験ネットワークの構築事業」において整備した基盤の継続性の確保、
臨床研究中核病院を中心とした国内における臨床研究支援人材育成強化、更なる拠点の整備を推進し、日本主導のアジア地域における国際
共同臨床研究・治験の実施体制の強化を図る。
6