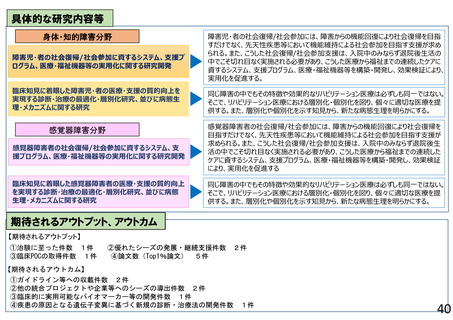
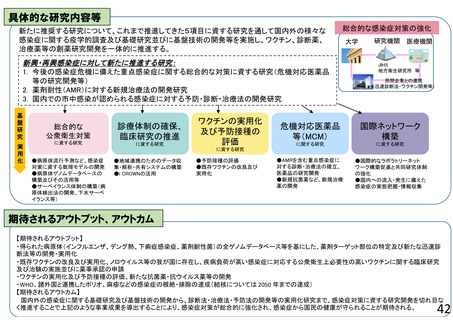
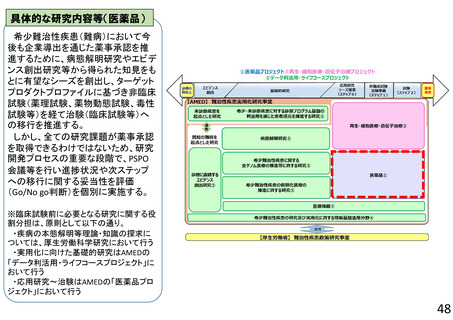
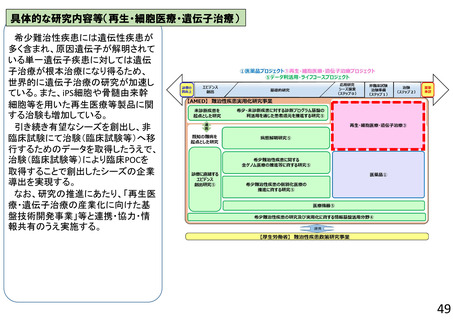
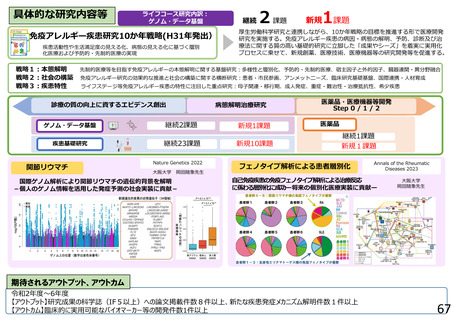
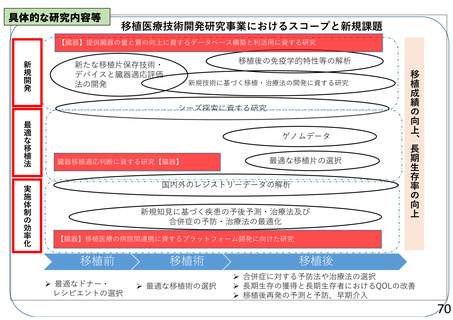
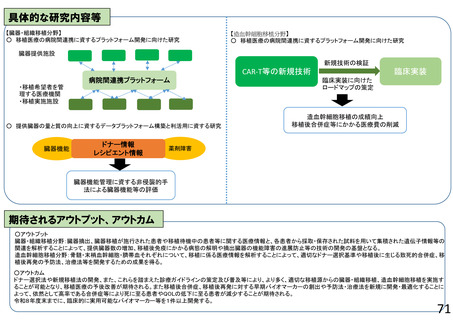
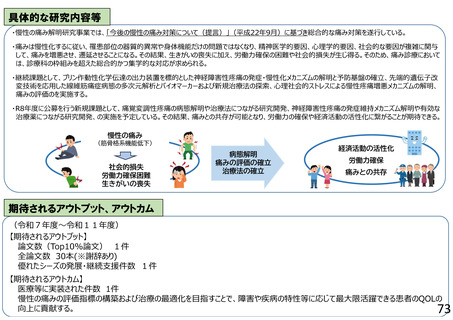
よむ、つかう、まなぶ。
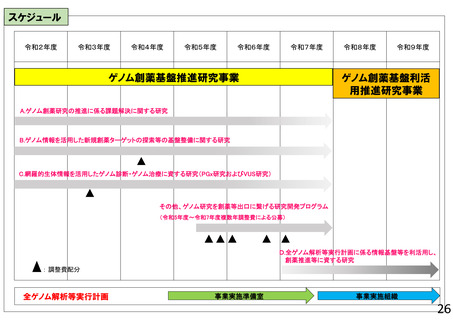
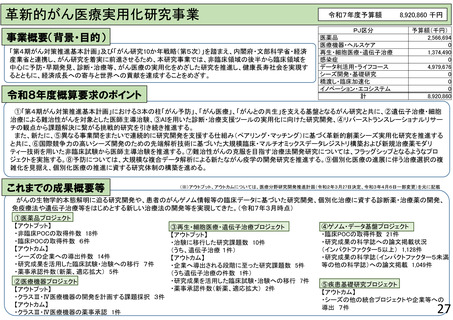
【資料1-2】令和8年度研究事業実施方針(AMED研究)(案)の概要 (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59644.html |
| 出典情報 | 厚生科学審議会 科学技術部会(第145回 7/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
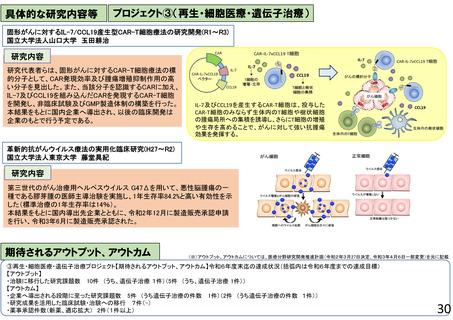
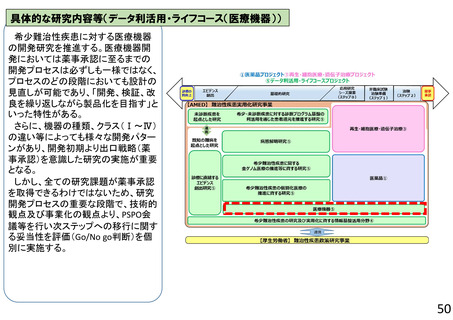
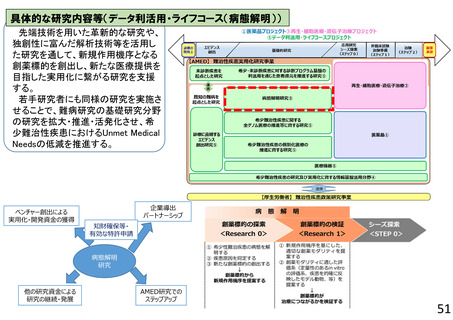
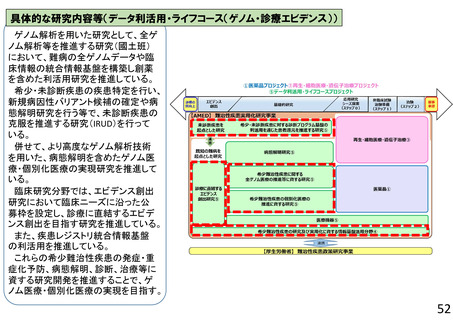
再生・細胞医療・遺伝子治療プロジェクト
令和8年度概算要求額 3,888,748千円
(令和7年度予算案 3,240,624千円
円)
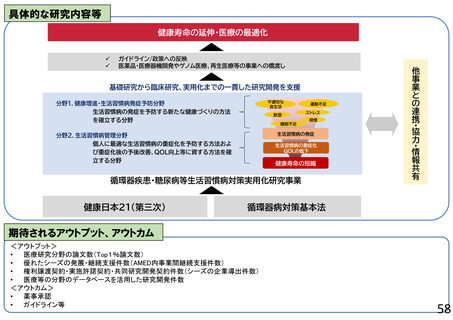
再生医療等実用化研究事業
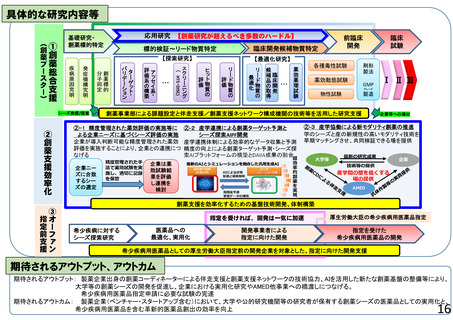
○ 再生医療等(再生・細胞・遺伝子治療(in vivo遺伝子治療を含む))の新規モダリティ等(技術・手法)の実用化に向けて、画期的で革新的な臨床研究・医師
主導治験、製法開発や、臨床研究・医師主導治験のうち実用化までの道筋が明確な研究、アカデミアと企業が協力して製造販売承認を目指す研究、再生医療等の品
質及び安全性を担保する評価基準策定に向けた研究、また臨床研究等の実施中に生じた課題解決のための研究等を支援する。これにより、再生医療等製品等の治
験・先進医療実施へ着実に繋げる。日本国内だけでなく海外展開可能な再生医療等技術の確立を目指す研究を特に重視する。
○ 令和8年度においても、画期的で革新的な技術等を用いた臨床研究・医師主導治験、又は実用化の道筋が明確で実現可能性が高く期待される製法開発のための
研究や臨床研究・医師主導治験を支援する。産学連携による研究においては、アカデミアがシーズ研究を行い、研究結果をもとに製造販売承認に向けて企業とも協力し、
臨床開発の早期から明確な出口戦略が検討された品質・非臨床データの取得のための研究や医師主導治験等を支援し、再生医療等製品等の治験や先進医療の着
実な実施に繋げる。
○ 若手・女性研究者を含めた人材育成については特に努めることとする。再生・細胞医療・遺伝子治療の融合研究及び異分野連携による研究の推進を行う。
1)再生・細胞医療、遺伝子治療の実用化に向けた研究の支援
2)創薬応用に向けた研究の支援
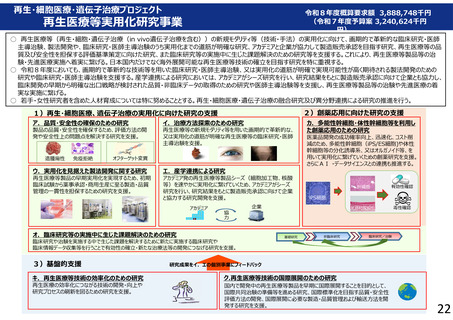
ア.品質・安全性の確保のための研究
カ.多能性幹細胞・体性幹細胞等を利用し
た創薬応用のための研究
製品の品質・安全性を確保するため、評価方法の開
発や安全性上の問題点を解決する研究を支援。
造腫瘍性
免疫拒絶
イ.治療方法探索のための研究
再生医療等の新規モダリティ等を用いた画期的で革新的な、
又は実用化の道筋が明確な再生医療等の臨床研究・医師
主導治験を支援。
オフターゲット変異
ウ.実用化を見据えた製法開発に関する研究
再生医療等製品の早期実用化を実現するため、初期
臨床試験から薬事承認・商用生産に至る製造・品質
管理の一貫性を担保するための研究を支援。
医薬品開発の成功確率向上、迅速化、コスト削
減のため、多能性幹細胞(iPS/ES細胞)や体性
幹細胞等の分化誘導系、又はオルガノイド等、を
用いて実用化に繋げていくための創薬研究を支援。
さらにAI ・データサイエンスとの連携も推進する。
エ.産学連携による研究
アカデミア発の再生医療等製品シーズ(細胞加工物、核酸
等)を速やかに実用化に繋げていくため、アカデミアがシーズ
研究を行い、研究結果をもとに製造販売承認に向けて企業
と協力する研究開発を支援。
協力
アカデミア
肝細胞
有効性確認
気道粘膜細胞
毒性確認
iPS細胞
企業
肝細胞
オ.臨床研究等の実施中に生じた課題解決のための研究
臨床研究や治験を実施する中で生じた課題を解決するために新たに実施する臨床研究や
臨床情報データ収集等を行うことで有効性の確立・新たな治療法等の開発につなげる研究を支援。
3)基盤的支援
キ.再生医療等技術の効率化のための研究
再生医療の効率化につながる技術の開発・向上や
研究プロセスの刷新を図るための研究を支援。
基礎研究
非臨床研究
臨床研究/治験
研究成果をイ.エの個別事業にフィードバック
ク.再生医療等技術の国際展開のための研究
国内で開発中の再生医療等製品を早期に国際展開することを目的として、
国際共同治験の準備等を進める研究、国際標準化を目指す品質・安全性
評価方法の開発、国際展開に必要な製造・品質管理および輸送方法を開
発する研究を支援。
22
令和8年度概算要求額 3,888,748千円
(令和7年度予算案 3,240,624千円
円)
再生医療等実用化研究事業
○ 再生医療等(再生・細胞・遺伝子治療(in vivo遺伝子治療を含む))の新規モダリティ等(技術・手法)の実用化に向けて、画期的で革新的な臨床研究・医師
主導治験、製法開発や、臨床研究・医師主導治験のうち実用化までの道筋が明確な研究、アカデミアと企業が協力して製造販売承認を目指す研究、再生医療等の品
質及び安全性を担保する評価基準策定に向けた研究、また臨床研究等の実施中に生じた課題解決のための研究等を支援する。これにより、再生医療等製品等の治
験・先進医療実施へ着実に繋げる。日本国内だけでなく海外展開可能な再生医療等技術の確立を目指す研究を特に重視する。
○ 令和8年度においても、画期的で革新的な技術等を用いた臨床研究・医師主導治験、又は実用化の道筋が明確で実現可能性が高く期待される製法開発のための
研究や臨床研究・医師主導治験を支援する。産学連携による研究においては、アカデミアがシーズ研究を行い、研究結果をもとに製造販売承認に向けて企業とも協力し、
臨床開発の早期から明確な出口戦略が検討された品質・非臨床データの取得のための研究や医師主導治験等を支援し、再生医療等製品等の治験や先進医療の着
実な実施に繋げる。
○ 若手・女性研究者を含めた人材育成については特に努めることとする。再生・細胞医療・遺伝子治療の融合研究及び異分野連携による研究の推進を行う。
1)再生・細胞医療、遺伝子治療の実用化に向けた研究の支援
2)創薬応用に向けた研究の支援
ア.品質・安全性の確保のための研究
カ.多能性幹細胞・体性幹細胞等を利用し
た創薬応用のための研究
製品の品質・安全性を確保するため、評価方法の開
発や安全性上の問題点を解決する研究を支援。
造腫瘍性
免疫拒絶
イ.治療方法探索のための研究
再生医療等の新規モダリティ等を用いた画期的で革新的な、
又は実用化の道筋が明確な再生医療等の臨床研究・医師
主導治験を支援。
オフターゲット変異
ウ.実用化を見据えた製法開発に関する研究
再生医療等製品の早期実用化を実現するため、初期
臨床試験から薬事承認・商用生産に至る製造・品質
管理の一貫性を担保するための研究を支援。
医薬品開発の成功確率向上、迅速化、コスト削
減のため、多能性幹細胞(iPS/ES細胞)や体性
幹細胞等の分化誘導系、又はオルガノイド等、を
用いて実用化に繋げていくための創薬研究を支援。
さらにAI ・データサイエンスとの連携も推進する。
エ.産学連携による研究
アカデミア発の再生医療等製品シーズ(細胞加工物、核酸
等)を速やかに実用化に繋げていくため、アカデミアがシーズ
研究を行い、研究結果をもとに製造販売承認に向けて企業
と協力する研究開発を支援。
協力
アカデミア
肝細胞
有効性確認
気道粘膜細胞
毒性確認
iPS細胞
企業
肝細胞
オ.臨床研究等の実施中に生じた課題解決のための研究
臨床研究や治験を実施する中で生じた課題を解決するために新たに実施する臨床研究や
臨床情報データ収集等を行うことで有効性の確立・新たな治療法等の開発につなげる研究を支援。
3)基盤的支援
キ.再生医療等技術の効率化のための研究
再生医療の効率化につながる技術の開発・向上や
研究プロセスの刷新を図るための研究を支援。
基礎研究
非臨床研究
臨床研究/治験
研究成果をイ.エの個別事業にフィードバック
ク.再生医療等技術の国際展開のための研究
国内で開発中の再生医療等製品を早期に国際展開することを目的として、
国際共同治験の準備等を進める研究、国際標準化を目指す品質・安全性
評価方法の開発、国際展開に必要な製造・品質管理および輸送方法を開
発する研究を支援。
22