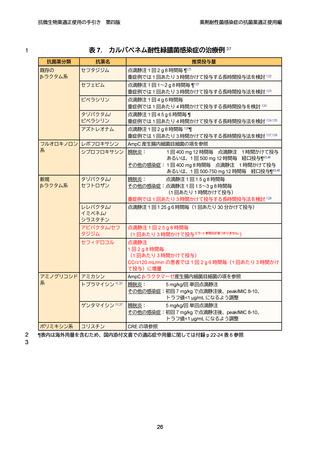
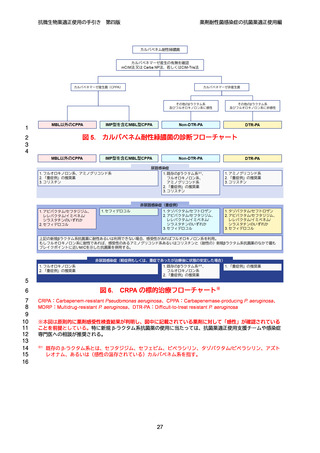
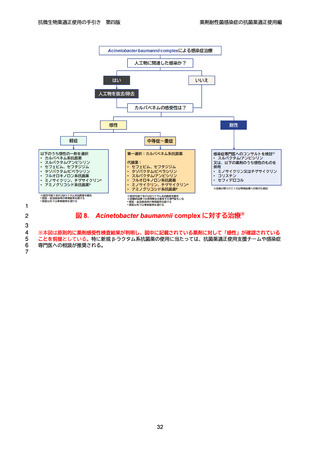
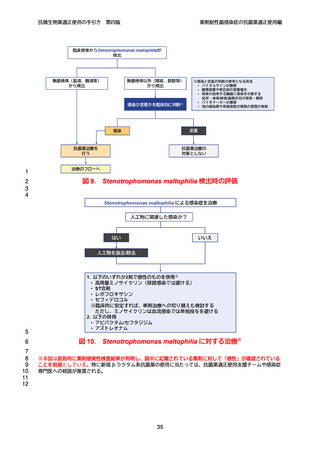
よむ、つかう、まなぶ。
【参考資料2-3】抗微生物薬適正使用の手引き 第四版(案)薬剤耐性菌感染症の抗菌薬適正使用編 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64503.html |
| 出典情報 | 厚生科学審議会 感染症部会(第99回 10/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
抗微生物薬適正使用の手引き
第四版
薬剤耐性菌感染症の抗菌薬適正使用編
1
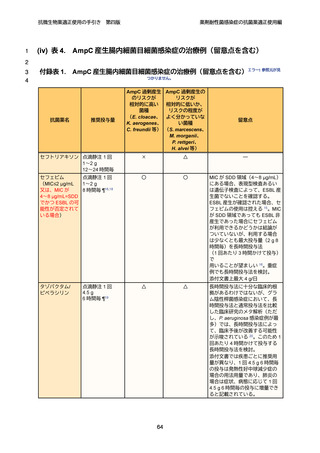
(ii) AmpC β-ラクタマーゼ産生腸内細菌目細菌
2
疫学の概要と臨床的特徴
3
AmpC 遺 伝 子 を 染 色 体 に コ ー ド す る 代 表 的 な 腸 内 細 菌 目 細 菌 と し て は 、
cloacae、Klebsiella
aerogenes、Citrobacter
freundii、Serratia
4
Enterobacter
5
marcescens、Morganella morganii、Providencia rettgeri、Hafnia alvei 等がある。
6
染色体性 AmpC 産生腸内細菌目細菌(以下、染色体性 AmpC 産生菌)感染症の最
7
大の特徴は、治療前に第 3 世代以下のセファロスポリン系抗菌薬に感性があったと
8
しても、同剤で治療中に AmpC を過剰産生することで耐性化し、最終的に治療に失
9
敗する可能性がある、という点である。臨床研究での治療中の耐性化率は最大でも
10
約 20%程度 46 であり、また耐性化する(つまり、微生物学的な治療失敗)ことが即
11
ち、臨床的に治療に失敗するということを意味するわけではない 47。第 3 世代セファ
12
ロスポリン系抗菌薬に曝露した場合に耐性化するリスクは、前述の染色体性 AmpC
13
産生菌の菌種間でも差があり、具体的には E. cloacae、K. aerogenes、C. freundii の
14
3 菌種ではリスクが高い一方 48 で、それ以外の菌種では、相対的にリスクが低いか、
15
あるいはリスクがどの程度なのかまだ分かっていない。
16
また、AmpC 遺伝子を染色体にコードしていない肺炎桿菌、Klebsiella oxytoca、
17
Proteus mirabilis あるいは染色体にコードしていてもそれが臨床的に問題となること
18
が殆どない大腸菌等の菌種でも、プラスミド等を介して、染色体性 AmpC 産生菌由
19
来の AmpC 遺伝子を獲得する場合がある。これらのプラスミド性 AmpC 産生菌は、
20
原則的に感受性検査では第 3 世代以下のセファロスポリン系抗菌薬に非感性を示す。
21
22
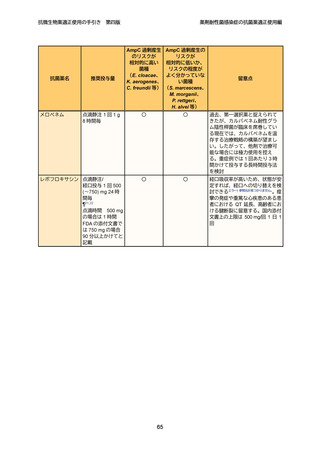
微生物学的診断
23
プラスミド性 AmpC 産生大腸菌及び肺炎桿菌、K. oxytoca、P. mirabilis 等の菌種で
24
は、第 3 世代セファロスポリン系抗菌薬に非感性を示した場合、ESBL との鑑別が必
25
要になる。ESBL 産生の場合、セファマイシン系やオキサセフェム系抗菌薬に感性を
26
示す一方で、プラスミド性 AmpC では多くの場合、低感性~非感性を示す。スクリ
27
ーニング陽性株に対しては、表現型等による確認検査を行う(付録 p.9 参照)。薬剤
28
感受性検査を実施する。
29
30
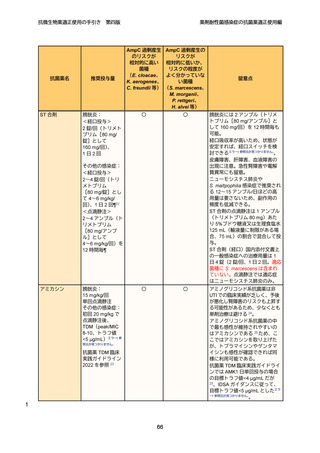
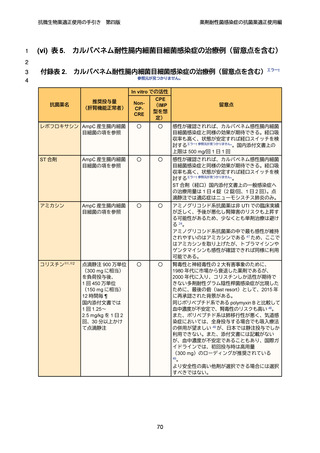
治療方針
31
第 4 世代セファロスポリン系抗菌薬であるセフェピムは、AmpC 過剰産生株に対
32
しても活性が安定しており、観察研究では染色体性 AmpC 産生菌感染症において、
33
カルバペネム系抗菌薬と同等の治療成績が報告されており 49、現時点での第一選択
34
薬となる。ただし、染色体性 AmpC 産生菌において、セフェピムの MIC が感性域
12
第四版
薬剤耐性菌感染症の抗菌薬適正使用編
1
(ii) AmpC β-ラクタマーゼ産生腸内細菌目細菌
2
疫学の概要と臨床的特徴
3
AmpC 遺 伝 子 を 染 色 体 に コ ー ド す る 代 表 的 な 腸 内 細 菌 目 細 菌 と し て は 、
cloacae、Klebsiella
aerogenes、Citrobacter
freundii、Serratia
4
Enterobacter
5
marcescens、Morganella morganii、Providencia rettgeri、Hafnia alvei 等がある。
6
染色体性 AmpC 産生腸内細菌目細菌(以下、染色体性 AmpC 産生菌)感染症の最
7
大の特徴は、治療前に第 3 世代以下のセファロスポリン系抗菌薬に感性があったと
8
しても、同剤で治療中に AmpC を過剰産生することで耐性化し、最終的に治療に失
9
敗する可能性がある、という点である。臨床研究での治療中の耐性化率は最大でも
10
約 20%程度 46 であり、また耐性化する(つまり、微生物学的な治療失敗)ことが即
11
ち、臨床的に治療に失敗するということを意味するわけではない 47。第 3 世代セファ
12
ロスポリン系抗菌薬に曝露した場合に耐性化するリスクは、前述の染色体性 AmpC
13
産生菌の菌種間でも差があり、具体的には E. cloacae、K. aerogenes、C. freundii の
14
3 菌種ではリスクが高い一方 48 で、それ以外の菌種では、相対的にリスクが低いか、
15
あるいはリスクがどの程度なのかまだ分かっていない。
16
また、AmpC 遺伝子を染色体にコードしていない肺炎桿菌、Klebsiella oxytoca、
17
Proteus mirabilis あるいは染色体にコードしていてもそれが臨床的に問題となること
18
が殆どない大腸菌等の菌種でも、プラスミド等を介して、染色体性 AmpC 産生菌由
19
来の AmpC 遺伝子を獲得する場合がある。これらのプラスミド性 AmpC 産生菌は、
20
原則的に感受性検査では第 3 世代以下のセファロスポリン系抗菌薬に非感性を示す。
21
22
微生物学的診断
23
プラスミド性 AmpC 産生大腸菌及び肺炎桿菌、K. oxytoca、P. mirabilis 等の菌種で
24
は、第 3 世代セファロスポリン系抗菌薬に非感性を示した場合、ESBL との鑑別が必
25
要になる。ESBL 産生の場合、セファマイシン系やオキサセフェム系抗菌薬に感性を
26
示す一方で、プラスミド性 AmpC では多くの場合、低感性~非感性を示す。スクリ
27
ーニング陽性株に対しては、表現型等による確認検査を行う(付録 p.9 参照)。薬剤
28
感受性検査を実施する。
29
30
治療方針
31
第 4 世代セファロスポリン系抗菌薬であるセフェピムは、AmpC 過剰産生株に対
32
しても活性が安定しており、観察研究では染色体性 AmpC 産生菌感染症において、
33
カルバペネム系抗菌薬と同等の治療成績が報告されており 49、現時点での第一選択
34
薬となる。ただし、染色体性 AmpC 産生菌において、セフェピムの MIC が感性域
12