よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施行令」、「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて[958KB] (75 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
を求めているものであること。文書は、その内容等に応じて定期的に確認され、更新され
るものとすること。使用されなくなった文書については適切に保管すること。
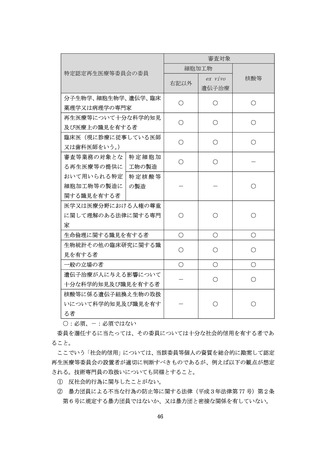
(76)省令第 110 条第2号関係
手順書等の作成又は改訂に当たっては、当該手順書等に作成又は改訂の日付のほか、そ
の責任者、内容及び理由を記載するとともに、当該改訂以前の改訂に係る履歴を保管し、
最新の改訂状況を識別することができるようにしておくことを求めているものであるこ
と。なお、手順書等の写し(正本との混同等を防止するために識別表示等の措置を講じる
こと。
)が存在する場合において、当該手順書等を改訂するときには、正本を改訂すると
同時に写しの配布及び差替えを行う等、全ての写しが確実に改訂されるようにすること。
(77)省令第 110 条第3号関係
特定細胞加工物等による感染症、腫瘍化等が万一発生した場合における調査等を可能
とするため、特定生物由来製品該当医薬品又は指定再生医療等製品の原料と類似の原料
からなる特定細胞加工物等にあっては 30 年間、その他の特定細胞加工物等にあっては、
10 年間記録を保管するものであること。また、手順書等の改訂に係る履歴も本規定に含
むこととすること。なお、使用されなくなった文書については適切に保管すること。
イの「特定生物由来製品該当医薬品又は指定再生医療等製品の原料と類似の原料から
なる特定細胞加工物等」については、Ⅴ(23)省令第 34 条第3項第1号関係の記載を参
照すること。
(78)省令第 112 条第1項第1号関係
「製造件数」とは、特定細胞加工物等ごとの製造件数をいうものであること。
(79)省令第 112 条第2項関係
厚生労働大臣又は地方厚生局長への報告は、別紙様式第8による報告書を提出して行
うものとすること。
以上
75
るものとすること。使用されなくなった文書については適切に保管すること。
(76)省令第 110 条第2号関係
手順書等の作成又は改訂に当たっては、当該手順書等に作成又は改訂の日付のほか、そ
の責任者、内容及び理由を記載するとともに、当該改訂以前の改訂に係る履歴を保管し、
最新の改訂状況を識別することができるようにしておくことを求めているものであるこ
と。なお、手順書等の写し(正本との混同等を防止するために識別表示等の措置を講じる
こと。
)が存在する場合において、当該手順書等を改訂するときには、正本を改訂すると
同時に写しの配布及び差替えを行う等、全ての写しが確実に改訂されるようにすること。
(77)省令第 110 条第3号関係
特定細胞加工物等による感染症、腫瘍化等が万一発生した場合における調査等を可能
とするため、特定生物由来製品該当医薬品又は指定再生医療等製品の原料と類似の原料
からなる特定細胞加工物等にあっては 30 年間、その他の特定細胞加工物等にあっては、
10 年間記録を保管するものであること。また、手順書等の改訂に係る履歴も本規定に含
むこととすること。なお、使用されなくなった文書については適切に保管すること。
イの「特定生物由来製品該当医薬品又は指定再生医療等製品の原料と類似の原料から
なる特定細胞加工物等」については、Ⅴ(23)省令第 34 条第3項第1号関係の記載を参
照すること。
(78)省令第 112 条第1項第1号関係
「製造件数」とは、特定細胞加工物等ごとの製造件数をいうものであること。
(79)省令第 112 条第2項関係
厚生労働大臣又は地方厚生局長への報告は、別紙様式第8による報告書を提出して行
うものとすること。
以上
75