よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施行令」、「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて[958KB] (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
者の意思に影響を与える可能性のある情報が得られたときは、速やかに説明文書
を改訂すること。様式を改訂する場合には、改訂番号及び改訂日を記載し、版管理
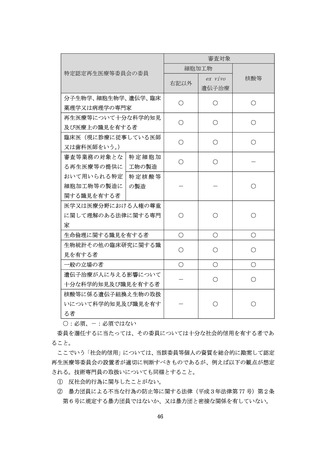
を適切に行うこと。なお、様式を改訂するためには、認定再生医療等委員会の意見
を聴いた上で、再生医療等提供計画の変更の手続を行う必要がある。
なお、説明については、
「厚生労働省の所管する法令の規定に基づく民間事業者等が行
う書面の保存等における情報通信の技術の利用に関する省令」に基づく電磁的記録に記
録されている事項の交付等を行うことができる。
(36)省令第 13 条第2項第3号関係
研究として再生医療等を行う際には、「提供される再生医療等の目的及び内容」に当該
研究の目的並びに意義及び研究方法を含むこと。
(37)省令第 13 条第2項第4号関係
「当該再生医療等に用いる細胞に関する情報」には少なくとも以下の内容を含めるこ
と。なお、核酸等を用いる場合は「当該再生医療等に用いる細胞に関する情報」は必要と
しない。
①
細胞加工物の構成細胞となる細胞に関する事項
②
細胞の提供を受ける医療機関等の名称
③
細胞の採取の方法
④
細胞の加工の方法
(38)省令第 13 条第2項第5号関係
「再生医療等を受ける者として選定された理由」(研究として再生医療等を行う場合に
限る。
)については、以下の項目を含めること。
①
再生医療等を受ける者の選択及び除外基準
②
研究の方法に応じた選定方法の説明(例えば、無作為割り付けを行う場合には、そ
の内容やその割合等)
③
それまでに分かっている当該再生医療等による主な副作用等の説明(主要なもの
を例示して説明するとともに、説明文書等においては網羅的に示すこと。
)
(39)省令第 13 条第2項第6号関係
「当該再生医療等の実施により予期される利益及び不利益」は、予期される臨床上の利
益及び不利益をいい、再生医療等を受ける者にとって予期される利益がない場合はその
旨を説明すること。
また、再生医療等に使用する特定細胞加工物等を製造するに当たり、ヒトその他の生物
に由来する原料等が用いられる場合は、生物由来原料基準(平成 15 年厚生労働省告示第
210 号)に適合していることが望ましいと考えられるところ、生物由来原料基準に適合し
ていることが必ずしも確認されていない又は適合していない原料等が用いられる場合は、
再生医療等を受ける者に対する説明同意文書において、当該事実及び当該原料等が使用
されることにより生じ得るリスク等について明記するなど、再生医療等を提供する医師
29
を改訂すること。様式を改訂する場合には、改訂番号及び改訂日を記載し、版管理
を適切に行うこと。なお、様式を改訂するためには、認定再生医療等委員会の意見
を聴いた上で、再生医療等提供計画の変更の手続を行う必要がある。
なお、説明については、
「厚生労働省の所管する法令の規定に基づく民間事業者等が行
う書面の保存等における情報通信の技術の利用に関する省令」に基づく電磁的記録に記
録されている事項の交付等を行うことができる。
(36)省令第 13 条第2項第3号関係
研究として再生医療等を行う際には、「提供される再生医療等の目的及び内容」に当該
研究の目的並びに意義及び研究方法を含むこと。
(37)省令第 13 条第2項第4号関係
「当該再生医療等に用いる細胞に関する情報」には少なくとも以下の内容を含めるこ
と。なお、核酸等を用いる場合は「当該再生医療等に用いる細胞に関する情報」は必要と
しない。
①
細胞加工物の構成細胞となる細胞に関する事項
②
細胞の提供を受ける医療機関等の名称
③
細胞の採取の方法
④
細胞の加工の方法
(38)省令第 13 条第2項第5号関係
「再生医療等を受ける者として選定された理由」(研究として再生医療等を行う場合に
限る。
)については、以下の項目を含めること。
①
再生医療等を受ける者の選択及び除外基準
②
研究の方法に応じた選定方法の説明(例えば、無作為割り付けを行う場合には、そ
の内容やその割合等)
③
それまでに分かっている当該再生医療等による主な副作用等の説明(主要なもの
を例示して説明するとともに、説明文書等においては網羅的に示すこと。
)
(39)省令第 13 条第2項第6号関係
「当該再生医療等の実施により予期される利益及び不利益」は、予期される臨床上の利
益及び不利益をいい、再生医療等を受ける者にとって予期される利益がない場合はその
旨を説明すること。
また、再生医療等に使用する特定細胞加工物等を製造するに当たり、ヒトその他の生物
に由来する原料等が用いられる場合は、生物由来原料基準(平成 15 年厚生労働省告示第
210 号)に適合していることが望ましいと考えられるところ、生物由来原料基準に適合し
ていることが必ずしも確認されていない又は適合していない原料等が用いられる場合は、
再生医療等を受ける者に対する説明同意文書において、当該事実及び当該原料等が使用
されることにより生じ得るリスク等について明記するなど、再生医療等を提供する医師
29