よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施行令」、「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて[958KB] (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
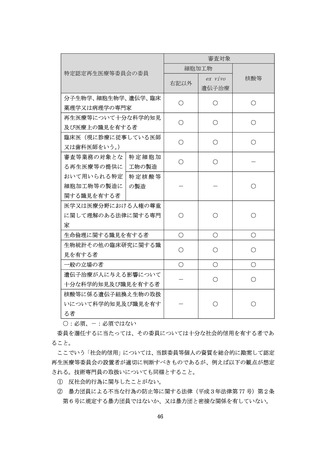
地並びに委託する業務の内容及び監督方法
② 「研究の背景に関する事項」は、当該研究の必要性及び課題設定を明確化する観点
から、以下に掲げる点について、参考文献、根拠データ等に基づき、分かりやすく
簡潔に記載すること。
(ア)国内外における対象疾患の状況(対象疾患に関する疫学データを含む。)
(イ)これまでに行われてきた標準治療の経緯及び内容
(ウ)現在の標準治療の内容及び治療成績
(エ)当該研究の必要性につながる、現在の標準治療の課題、不明点等
(オ)当該研究に用いる細胞及び細胞加工物又は核酸等に関する以下の情報
ⅰ)当該細胞の名称(特定細胞加工物を用いる研究に限る。
)
ⅱ)当該特定細胞加工物等の名称(特定細胞加工物等を用いる研究に限る。
)
ⅲ)当該再生医療等製品又は医薬品の一般的名称及び販売名(再生医療等製品又は
医薬品を用いる研究に限る。)
ⅳ)当該特定細胞加工物等にあっては投与量(細胞加工物を用いる場合は細胞数を
含む。
)や投与速度を含む具体的な投与方法、投与回数及び投与間隔、再生医療
等製品にあっては用法、用量又は使用方法並びに効能、効果又は性能、医薬品に
あっては、用法及び用量並びに効能又は効果(再生医療等製品または医薬品を用
いる場合は、医薬品医療機器等法に基づく製造販売承認に係る添付文書の情報
を記載すること。)
ⅴ)当該細胞加工物又は核酸等の対象集団(年齢層、性別、疾患等)
ⅵ)当該細胞加工物又は核酸等の使用の安全性及び妥当性に関して、非臨床試験、
他の研究等から得られている臨床的に重要な所見
ⅶ)当該細胞加工物又は核酸等の使用による利益及び不利益(既知のもの及び可能
性のあるもの)
(カ)未承認又は適応外の医薬品(核酸等に該当するものに限らない。)又は医療機器
を用いる場合には、当該医薬品又は医療機器に関する以下の情報
ⅰ)一般的名称及び販売名
ⅱ)投与経路、用法、用量及び投与期間
ⅲ)対象集団(年齢層、性別、疾患等)
ⅳ)有効性又は安全性に関して、非臨床試験、他の研究等から得られている臨床的
に重要な所見
ⅴ)投与等による利益及び不利益(既知のもの及び可能性のあるもの)
③ 「研究の目的に関する事項」は、上記②を踏まえ、当該研究の技術的事項(研究
デザイン)の適切性が判断できるよう、当該研究で明らかにしようとしている点
(課題設定)について、分かりやすく簡潔に記載すること。
④ 「研究の内容に関する事項」は、上記②及び③を踏まえ、当該研究の技術的事項
19
② 「研究の背景に関する事項」は、当該研究の必要性及び課題設定を明確化する観点
から、以下に掲げる点について、参考文献、根拠データ等に基づき、分かりやすく
簡潔に記載すること。
(ア)国内外における対象疾患の状況(対象疾患に関する疫学データを含む。)
(イ)これまでに行われてきた標準治療の経緯及び内容
(ウ)現在の標準治療の内容及び治療成績
(エ)当該研究の必要性につながる、現在の標準治療の課題、不明点等
(オ)当該研究に用いる細胞及び細胞加工物又は核酸等に関する以下の情報
ⅰ)当該細胞の名称(特定細胞加工物を用いる研究に限る。
)
ⅱ)当該特定細胞加工物等の名称(特定細胞加工物等を用いる研究に限る。
)
ⅲ)当該再生医療等製品又は医薬品の一般的名称及び販売名(再生医療等製品又は
医薬品を用いる研究に限る。)
ⅳ)当該特定細胞加工物等にあっては投与量(細胞加工物を用いる場合は細胞数を
含む。
)や投与速度を含む具体的な投与方法、投与回数及び投与間隔、再生医療
等製品にあっては用法、用量又は使用方法並びに効能、効果又は性能、医薬品に
あっては、用法及び用量並びに効能又は効果(再生医療等製品または医薬品を用
いる場合は、医薬品医療機器等法に基づく製造販売承認に係る添付文書の情報
を記載すること。)
ⅴ)当該細胞加工物又は核酸等の対象集団(年齢層、性別、疾患等)
ⅵ)当該細胞加工物又は核酸等の使用の安全性及び妥当性に関して、非臨床試験、
他の研究等から得られている臨床的に重要な所見
ⅶ)当該細胞加工物又は核酸等の使用による利益及び不利益(既知のもの及び可能
性のあるもの)
(カ)未承認又は適応外の医薬品(核酸等に該当するものに限らない。)又は医療機器
を用いる場合には、当該医薬品又は医療機器に関する以下の情報
ⅰ)一般的名称及び販売名
ⅱ)投与経路、用法、用量及び投与期間
ⅲ)対象集団(年齢層、性別、疾患等)
ⅳ)有効性又は安全性に関して、非臨床試験、他の研究等から得られている臨床的
に重要な所見
ⅴ)投与等による利益及び不利益(既知のもの及び可能性のあるもの)
③ 「研究の目的に関する事項」は、上記②を踏まえ、当該研究の技術的事項(研究
デザイン)の適切性が判断できるよう、当該研究で明らかにしようとしている点
(課題設定)について、分かりやすく簡潔に記載すること。
④ 「研究の内容に関する事項」は、上記②及び③を踏まえ、当該研究の技術的事項
19