よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施行令」、「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて[958KB] (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
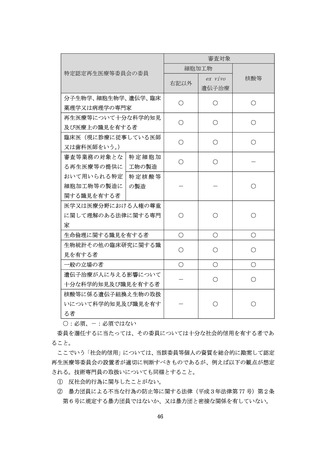
(研究デザイン)として、以下に掲げる点について、分かりやすく簡潔に記載する
こと。また、再生医療等の内容をできる限り平易な表現を用いて記載したもの(当
該再生医療等の内容を簡潔に図解したものが含まれることが望ましい。
)を添付す
ること。なお、⑨の記載事項及び統計解析計画書を作成した場合は当該文書の記載
との整合性をとること。
(ア)研究における主要評価項目及び副次評価項目に関する説明
(イ)実施される研究の種類及び手法(例えば、単腕試験、群間比較試験等)の説明並
びに研究の手順(段階等を図式化した表示等)
(ウ)研究におけるバイアス等を最小限にする又は避けるためにとられる無作為化及
び盲検化等の方法の説明
(エ)研究に用いる細胞に関する説明(細胞を用いない場合を除く。
)
少なくとも、当該細胞の提供を受ける医療機関等(動物の細胞を用いる場合にあ
っては当該細胞の採取を行う機関等)の名称及び所在地、細胞提供者又はドナー動
物の選定方法及び適格性の確認方法並びに当該細胞の入手の方法の説明を含むこ
と。また、やむを得ず、同意の能力を欠く者、同意の任意性が損なわれるおそれの
ある者を細胞提供者とする場合には、その必然性を記載すること。
(オ)研究に用いる特定細胞加工物等の製造及び品質管理の方法に関する説明
少なくとも、当該特定細胞加工物等の製造及び品質管理の方法の概要、特定細胞
加工物等製造事業者及び特定細胞加工物等製造施設の名称及び所在地並びに委託
の内容を含むこと。
(カ)研究に用いる特定細胞加工物等、再生医療等製品及び医薬品等の用法及び用量又
は使用方法の説明並びに未承認の医薬品等を用いる場合にはその剤形及び表示に
関する説明
表示については、少なくとも、名称、製造番号又は製造記号、管理に係る事項(保
管方法等)について記載すること。
(キ)全ての研究の工程の説明
再生医療等を受ける者の参加予定期間及び観察期間(最初の症例を登録したと
きから研究の内容に関する事項として記載した全ての評価項目に係るデータの収
集を行うための期間が終了したときまでの期間をいう。以下同じ。
)における工程
を含むこと。また、研究終了後にも配慮が必要なため、研究終了後のフォローアッ
プの内容を明らかにすること。
(ク)研究に用いる特定細胞加工物等、再生医療等製品及び医薬品等の管理の手順
プラセボ及び対照薬等(研究において評価の対象となる細胞加工物又は核酸等
と比較する目的で用いられる医薬品等をいう。)の管理の手順を含むこと。また、
研究に用いる医薬品等を診療に用いる医薬品等と別に管理する必要がある場合に
は、その管理場所及び数量、据付け型医療機器の研究終了後の取扱い等を含むこと。
20
こと。また、再生医療等の内容をできる限り平易な表現を用いて記載したもの(当
該再生医療等の内容を簡潔に図解したものが含まれることが望ましい。
)を添付す
ること。なお、⑨の記載事項及び統計解析計画書を作成した場合は当該文書の記載
との整合性をとること。
(ア)研究における主要評価項目及び副次評価項目に関する説明
(イ)実施される研究の種類及び手法(例えば、単腕試験、群間比較試験等)の説明並
びに研究の手順(段階等を図式化した表示等)
(ウ)研究におけるバイアス等を最小限にする又は避けるためにとられる無作為化及
び盲検化等の方法の説明
(エ)研究に用いる細胞に関する説明(細胞を用いない場合を除く。
)
少なくとも、当該細胞の提供を受ける医療機関等(動物の細胞を用いる場合にあ
っては当該細胞の採取を行う機関等)の名称及び所在地、細胞提供者又はドナー動
物の選定方法及び適格性の確認方法並びに当該細胞の入手の方法の説明を含むこ
と。また、やむを得ず、同意の能力を欠く者、同意の任意性が損なわれるおそれの
ある者を細胞提供者とする場合には、その必然性を記載すること。
(オ)研究に用いる特定細胞加工物等の製造及び品質管理の方法に関する説明
少なくとも、当該特定細胞加工物等の製造及び品質管理の方法の概要、特定細胞
加工物等製造事業者及び特定細胞加工物等製造施設の名称及び所在地並びに委託
の内容を含むこと。
(カ)研究に用いる特定細胞加工物等、再生医療等製品及び医薬品等の用法及び用量又
は使用方法の説明並びに未承認の医薬品等を用いる場合にはその剤形及び表示に
関する説明
表示については、少なくとも、名称、製造番号又は製造記号、管理に係る事項(保
管方法等)について記載すること。
(キ)全ての研究の工程の説明
再生医療等を受ける者の参加予定期間及び観察期間(最初の症例を登録したと
きから研究の内容に関する事項として記載した全ての評価項目に係るデータの収
集を行うための期間が終了したときまでの期間をいう。以下同じ。
)における工程
を含むこと。また、研究終了後にも配慮が必要なため、研究終了後のフォローアッ
プの内容を明らかにすること。
(ク)研究に用いる特定細胞加工物等、再生医療等製品及び医薬品等の管理の手順
プラセボ及び対照薬等(研究において評価の対象となる細胞加工物又は核酸等
と比較する目的で用いられる医薬品等をいう。)の管理の手順を含むこと。また、
研究に用いる医薬品等を診療に用いる医薬品等と別に管理する必要がある場合に
は、その管理場所及び数量、据付け型医療機器の研究終了後の取扱い等を含むこと。
20