よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施行令」、「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて[958KB] (71 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
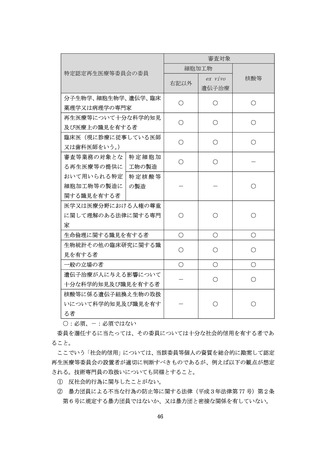
月日」及び「判定をした年月日」に関してはそれらに加えて「試験検査依頼年月日」及び
「試験検査結果の受理年月日」を併記するようにすること。
「当該特定細胞加工物等製造事業者の他の試験検査設備又は他の試験検査機関を利用
して自己の責任において行う試験検査」を行うこととは、当該特定細胞加工物等製造事業
者の職員に外部試験検査機関等を利用して試験検査を行わせること又は当該特定細胞加
工物等製造事業者の自己の責任で外部試験検査機関等に試験検査を依頼しその結果を判
定することを意味するものであること。これらの方法により試験検査を行う場合におい
ては、あらかじめ外部試験検査機関等と、相互の連絡方法、当該試験検査の委託に関し必
要な技術的条件、検体の運搬時における品質管理の方法等必要な事項について取り決め
ておくほか、次の措置を採ること。
① 特定細胞加工物等、原料又は資材ごとに試験検査依頼品目・特定細胞加工物等リ
ストを作成し、保存すること。なお、当該リストの記載事項に変更があったときに
は、その都度修正すること。
②
試験検査依頼に際しては、試験検査依頼書とともに検体の規格及び試験検査の方
法に関する情報を提供し、必要な量の検体を送付すること。なお、送付する検体につ
いては、次の事項を表示すること。
(ア)検体名
(イ)ロット番号若しくは製造番号又は管理番号
(ウ)特定細胞加工物等製造施設の名称
(エ)保管上の注意事項
(オ)その他必要な事項
なお、試験検査結果に関する記録としては、特定細胞加工物等の使用により疾病等が発
生したときに原因究明を行うために必要な記録を保管すること。
(54)省令第 100 条第1項第4号関係
本規定は、試験検査の結果の判定及びその結果の製造部門への文書による報告につい
て定めたものであること。
原料の試験検査が長い日数を要するものである場合において、手順書等に当該試験検
査の結果の取扱いが規定されている場合は、品質部門が当該試験検査の結果を文書で製
造部門に報告することを待たずに、当該原料を製造に用いることとしても差し支えない
こと。
(55)省令第 101 条関係
特定細胞加工物等製造施設からの特定細胞加工物等の提供については、必要な試験検
査の結果を含めた製造管理及び品質管理の結果の評価結果に基づき、医師又は歯科医師
が提供の可否の決定をした後に行うことが原則であること。特定細胞加工物等の微生物
学的安全性の評価については、今後別途通知される指針に基づき実施すること。
71
「試験検査結果の受理年月日」を併記するようにすること。
「当該特定細胞加工物等製造事業者の他の試験検査設備又は他の試験検査機関を利用
して自己の責任において行う試験検査」を行うこととは、当該特定細胞加工物等製造事業
者の職員に外部試験検査機関等を利用して試験検査を行わせること又は当該特定細胞加
工物等製造事業者の自己の責任で外部試験検査機関等に試験検査を依頼しその結果を判
定することを意味するものであること。これらの方法により試験検査を行う場合におい
ては、あらかじめ外部試験検査機関等と、相互の連絡方法、当該試験検査の委託に関し必
要な技術的条件、検体の運搬時における品質管理の方法等必要な事項について取り決め
ておくほか、次の措置を採ること。
① 特定細胞加工物等、原料又は資材ごとに試験検査依頼品目・特定細胞加工物等リ
ストを作成し、保存すること。なお、当該リストの記載事項に変更があったときに
は、その都度修正すること。
②
試験検査依頼に際しては、試験検査依頼書とともに検体の規格及び試験検査の方
法に関する情報を提供し、必要な量の検体を送付すること。なお、送付する検体につ
いては、次の事項を表示すること。
(ア)検体名
(イ)ロット番号若しくは製造番号又は管理番号
(ウ)特定細胞加工物等製造施設の名称
(エ)保管上の注意事項
(オ)その他必要な事項
なお、試験検査結果に関する記録としては、特定細胞加工物等の使用により疾病等が発
生したときに原因究明を行うために必要な記録を保管すること。
(54)省令第 100 条第1項第4号関係
本規定は、試験検査の結果の判定及びその結果の製造部門への文書による報告につい
て定めたものであること。
原料の試験検査が長い日数を要するものである場合において、手順書等に当該試験検
査の結果の取扱いが規定されている場合は、品質部門が当該試験検査の結果を文書で製
造部門に報告することを待たずに、当該原料を製造に用いることとしても差し支えない
こと。
(55)省令第 101 条関係
特定細胞加工物等製造施設からの特定細胞加工物等の提供については、必要な試験検
査の結果を含めた製造管理及び品質管理の結果の評価結果に基づき、医師又は歯科医師
が提供の可否の決定をした後に行うことが原則であること。特定細胞加工物等の微生物
学的安全性の評価については、今後別途通知される指針に基づき実施すること。
71