よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施行令」、「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて[958KB] (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
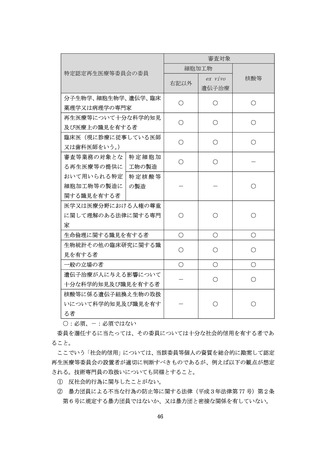
②
主要評価項目報告書及び総括報告書を作成しなければならない時期が同時期の場
合は、総括報告書の作成により主要評価項目報告書の作成をしたものとみなす。
(27)省令第8条の9第4項関係
①
主要評価項目報告書又は総括報告書の概要の公表については、当該研究成果を論
文等で公表する場合においては、認定再生医療等委員会に論文投稿中の旨を報告し
た上で、当該論文等の公表後としても差し支えない。この場合であっても厚生労働大
臣への提出は期限内に行い、当該提出時に公表時期について申し出ること。ただし、
研究論文等が公表された場合は、直ちに主要評価項目報告書又は総括報告書の概要
を公表することとし、総括報告書の概要の公表にあたっては、厚生労働大臣への提出
の際に未記入で提出した項目(「結果に関する最初の出版物での発表日」及び「結果
と出版物に関する URL」
)を jRCT に記録すること。
②
総括報告書の概要は、jRCT における研究結果の概要を登録したものでも差し支え
ない。
(28)省令第8条の9第5項関係
厚生労働大臣への総括報告書の概要の提出は、別紙様式第9を提出して行うものとす
ること。
(29)省令第8条の9第6項関係
提出された再生医療等提供計画は、地方厚生局において、記載不備を確認した上で、速
やかに公表されること。
(30)省令第9条関係
再生医療等を治療として行う場合においても、再生医療等を行う医師又は歯科医師は、
医の倫理に配慮して当該治療を適切に提供すること。
(31)省令第 10 条第1項関係
再生医療等を治療として行う場合における「妥当性」については、再生医療等を受ける
者の利益として、当該再生医療等の有効性が安全性におけるリスクを上回ることが十分
予測されることを含むものであること。このため、再生医療等を治療として実施する場合
には、再生医療等提供計画においては、当該再生医療等の有効性が安全性におけるリスク
を上回ることについて、科学的な根拠を示す必要があること。
「科学的文献その他の関連する情報」については、例えば、研究論文や学術集会の発表
が挙げられ、その妥当性については、
「
「認定再生医療等委員会の適切な審査等業務実施の
ためのガイダンス(手引き)
」について」(令和6年5月 13 日医政研発 0513 第1号)にお
ける科学的文献チェックリストを参考に判断すること。「十分な実験の結果」としては、
例えば、投与される細胞加工物の非臨床試験等が挙げられ、当該細胞加工物の安全性や妥
当性について、その時点での科学的水準に基づき可能な範囲で検討されていなければな
らない。
培養した幹細胞又は当該細胞に培養その他の加工を施したものを用いる再生医療等で
27
主要評価項目報告書及び総括報告書を作成しなければならない時期が同時期の場
合は、総括報告書の作成により主要評価項目報告書の作成をしたものとみなす。
(27)省令第8条の9第4項関係
①
主要評価項目報告書又は総括報告書の概要の公表については、当該研究成果を論
文等で公表する場合においては、認定再生医療等委員会に論文投稿中の旨を報告し
た上で、当該論文等の公表後としても差し支えない。この場合であっても厚生労働大
臣への提出は期限内に行い、当該提出時に公表時期について申し出ること。ただし、
研究論文等が公表された場合は、直ちに主要評価項目報告書又は総括報告書の概要
を公表することとし、総括報告書の概要の公表にあたっては、厚生労働大臣への提出
の際に未記入で提出した項目(「結果に関する最初の出版物での発表日」及び「結果
と出版物に関する URL」
)を jRCT に記録すること。
②
総括報告書の概要は、jRCT における研究結果の概要を登録したものでも差し支え
ない。
(28)省令第8条の9第5項関係
厚生労働大臣への総括報告書の概要の提出は、別紙様式第9を提出して行うものとす
ること。
(29)省令第8条の9第6項関係
提出された再生医療等提供計画は、地方厚生局において、記載不備を確認した上で、速
やかに公表されること。
(30)省令第9条関係
再生医療等を治療として行う場合においても、再生医療等を行う医師又は歯科医師は、
医の倫理に配慮して当該治療を適切に提供すること。
(31)省令第 10 条第1項関係
再生医療等を治療として行う場合における「妥当性」については、再生医療等を受ける
者の利益として、当該再生医療等の有効性が安全性におけるリスクを上回ることが十分
予測されることを含むものであること。このため、再生医療等を治療として実施する場合
には、再生医療等提供計画においては、当該再生医療等の有効性が安全性におけるリスク
を上回ることについて、科学的な根拠を示す必要があること。
「科学的文献その他の関連する情報」については、例えば、研究論文や学術集会の発表
が挙げられ、その妥当性については、
「
「認定再生医療等委員会の適切な審査等業務実施の
ためのガイダンス(手引き)
」について」(令和6年5月 13 日医政研発 0513 第1号)にお
ける科学的文献チェックリストを参考に判断すること。「十分な実験の結果」としては、
例えば、投与される細胞加工物の非臨床試験等が挙げられ、当該細胞加工物の安全性や妥
当性について、その時点での科学的水準に基づき可能な範囲で検討されていなければな
らない。
培養した幹細胞又は当該細胞に培養その他の加工を施したものを用いる再生医療等で
27