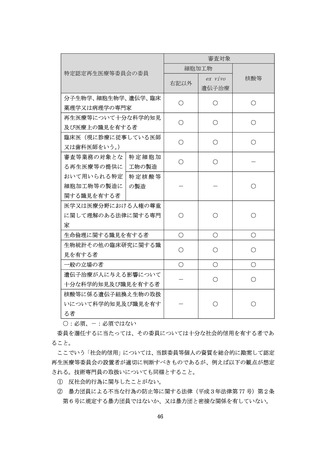
よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施行令」、「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて[958KB] (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
うる期間を考慮して実施するべきものであること。例えば、投与された特定細胞加工物等
に由来する腫瘍の発生が懸念される場合には、長期の経過を追跡する期間が求められる。
なお、再生医療の提供を受けた者が海外に居住する場合などにおいても、疾病等の発生の
有無について、適切な手段で追跡調査を行うことが求められる。
(58)省令第 19 条関係
「適切な措置」としては、例えば、再生医療等を終了する前に、治療においては必要な
治療後の経過を観察する期間、研究においては観察期間を設定することや、再生医療等の
提供が終了した後であっても長期の経過を追跡する期間を設定しておくこと、再生医療
等を受けた者の連絡先を把握しておくことが挙げられること。
(59)省令第 20 条第1項関係
再生医療等の提供を行う医療機関の管理者及び実施責任者は、細胞提供者や再生医療
等を受ける者に配慮し、再生医療等を行う医師又は歯科医師や当該再生医療等に従事す
る者による省令、再生医療等提供計画及び研究計画書(研究として再生医療を行う場合に
限る。
)の遵守を図るとともに、再生医療等の進捗管理や監督、疾病等や不適合の把握及
び報告並びに当該再生医療等に従事する者に対する適時な情報共有を行うこと。また、疾
病等や重大な不適合が発生した場合は、再発防止策を講じ、再生医療等を行う医師又は歯
科医師や当該再生医療等に従事する者に周知するとともに、再発防止の徹底を図ること。
(60)省令第 20 条の2第1項関係
「不適合」とは、省令又は再生医療等提供計画、研究計画書等の不遵守をいい、逸脱、
研究として再生医療等を行う場合は研究データの改ざん、ねつ造等を含む。なお、「不適
合」は、医薬品医療機器等法第 68 条の 10 の規定に基づき再生医療等製品に関して報告
が義務付けられる事項(
「副作用」や「不具合」
)とは異なるので留意すること。再生医療
等の提供において使用される医療機器や再生医療等製品について、医薬品医療機器等法
第 68 条の 10 の規定に基づき厚生労働大臣へ報告することが義務付けられている事項を
知った場合には、同法に基づく報告を行うこと。
(61)省令第 20 条の2第4項関係
「特に重大なもの」とは、細胞提供者又は再生医療等を受ける者の人権や安全性又は結
果の信頼性に影響を及ぼすものをいう。例えば、選択・除外基準や中止基準、併用禁止療
法等の不遵守をいい、再生医療等を受ける者の緊急の危険を回避するためその他医療上
やむを得ない理由により再生医療等提供計画、研究計画書に従わなかったものについて
は含まない。
認定再生医療等委員会への重大な不適合の報告は、別紙様式第 10 を提出して行うもの
とする。
(62)省令第 22 条第1項及び第2項関係
「その他の必要な措置」としては、例えば、健康被害に対する医療の提供が挙げられる
こと。
33
に由来する腫瘍の発生が懸念される場合には、長期の経過を追跡する期間が求められる。
なお、再生医療の提供を受けた者が海外に居住する場合などにおいても、疾病等の発生の
有無について、適切な手段で追跡調査を行うことが求められる。
(58)省令第 19 条関係
「適切な措置」としては、例えば、再生医療等を終了する前に、治療においては必要な
治療後の経過を観察する期間、研究においては観察期間を設定することや、再生医療等の
提供が終了した後であっても長期の経過を追跡する期間を設定しておくこと、再生医療
等を受けた者の連絡先を把握しておくことが挙げられること。
(59)省令第 20 条第1項関係
再生医療等の提供を行う医療機関の管理者及び実施責任者は、細胞提供者や再生医療
等を受ける者に配慮し、再生医療等を行う医師又は歯科医師や当該再生医療等に従事す
る者による省令、再生医療等提供計画及び研究計画書(研究として再生医療を行う場合に
限る。
)の遵守を図るとともに、再生医療等の進捗管理や監督、疾病等や不適合の把握及
び報告並びに当該再生医療等に従事する者に対する適時な情報共有を行うこと。また、疾
病等や重大な不適合が発生した場合は、再発防止策を講じ、再生医療等を行う医師又は歯
科医師や当該再生医療等に従事する者に周知するとともに、再発防止の徹底を図ること。
(60)省令第 20 条の2第1項関係
「不適合」とは、省令又は再生医療等提供計画、研究計画書等の不遵守をいい、逸脱、
研究として再生医療等を行う場合は研究データの改ざん、ねつ造等を含む。なお、「不適
合」は、医薬品医療機器等法第 68 条の 10 の規定に基づき再生医療等製品に関して報告
が義務付けられる事項(
「副作用」や「不具合」
)とは異なるので留意すること。再生医療
等の提供において使用される医療機器や再生医療等製品について、医薬品医療機器等法
第 68 条の 10 の規定に基づき厚生労働大臣へ報告することが義務付けられている事項を
知った場合には、同法に基づく報告を行うこと。
(61)省令第 20 条の2第4項関係
「特に重大なもの」とは、細胞提供者又は再生医療等を受ける者の人権や安全性又は結
果の信頼性に影響を及ぼすものをいう。例えば、選択・除外基準や中止基準、併用禁止療
法等の不遵守をいい、再生医療等を受ける者の緊急の危険を回避するためその他医療上
やむを得ない理由により再生医療等提供計画、研究計画書に従わなかったものについて
は含まない。
認定再生医療等委員会への重大な不適合の報告は、別紙様式第 10 を提出して行うもの
とする。
(62)省令第 22 条第1項及び第2項関係
「その他の必要な措置」としては、例えば、健康被害に対する医療の提供が挙げられる
こと。
33