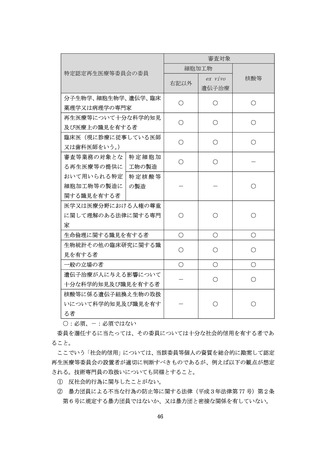
よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施行令」、「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて[958KB] (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(イ)読んで理解できること
(ウ)実施した内容について速やかに作成されること
(エ)原本性が担保されていること
(オ)正確なものであること
(カ)記録すべき内容が充足しており、完結性が担保されていること
(23)省令第 34 条第3項第1号関係
「当該特定生物由来製品該当医薬品若しくは当該指定再生医療等製品の原料と類似の
原料から成る特定細胞加工物等」とは、人その他の生物(植物を除く。)の細胞組織等(血
液を含む。
)を原料等として用いる特定細胞加工物等(培地成分、添加物等としてのみ使
用され、又は極めて高度な処理を受けていることにより、十分な感染因子のクリアランス
が確保され、感染症の罹患リスクが極めて低いものを除く。
)をいうものであること。例
えば、人の細胞組織等を原料等として用いる特定細胞加工物等として、ヒト血清アルブミ
ンを用いて製造した特定細胞加工物や他家のがん細胞等から抽出した mRNA を用いて製造
した特定核酸等(十分なウイルス不活化処理をして細胞から抽出された場合は除く。
)が
挙げられること。
(24)省令第 34 条第3項及び第4項関係
①
第4項について、多施設共同研究の継続中に、一の再生医療等提供機関において研
究を継続しないこととなった場合にも、当該医療機関は、自施設が研究を継続しない
こととなった日ではなく、研究全体が終了した日を起算日として、5年間記録を保存
すること。
②
第3項及び第4項について、再生医療等提供機関以外で委託業者や共同機関があ
る場合は、提供機関管理者の指導の下、委託業者や共同機関が当該再生医療等に関連
する記録を保存することもできる。この場合においては、研究計画書や契約において、
当該記録の保存について担保すること。
③
第3項の規定による省令第 27 条第8項第1号から第8号までに掲げる書類、再生
医療等を受ける者及び細胞提供者並びにこれらの代諾者に対する説明及びその同意
に係る文書並びに認定再生医療等委員会から受け取った審査等業務に係る文書並び
に第4項の規定による書類の保存については、
「厚生労働省の所管する法令の規定に
基づく民間事業者等が行う書面の保存等における情報通信の技術の利用に関する省
令」に基づく電磁的記録の保存を行うことができること。
(25)法第 17 条及び省令第 35 条関係
再生医療等提供機関の管理者は、法第 17 条の規定に基づき疾病等の報告の義務がある
ことから、同意説明文書において再生医療等提供機関の管理者が疾病等の報告の法的義
務を負っている旨を明記し、再生医療等の提供によるものと疑われる疾病、障害又は感染
症の症状の発生時又は当該疾病等が他院で治療された場合においても、速やかに当該再
生医療等を受けた者又はその家族等の代諾者等からの報告を受けられるように、事前に
40
(ウ)実施した内容について速やかに作成されること
(エ)原本性が担保されていること
(オ)正確なものであること
(カ)記録すべき内容が充足しており、完結性が担保されていること
(23)省令第 34 条第3項第1号関係
「当該特定生物由来製品該当医薬品若しくは当該指定再生医療等製品の原料と類似の
原料から成る特定細胞加工物等」とは、人その他の生物(植物を除く。)の細胞組織等(血
液を含む。
)を原料等として用いる特定細胞加工物等(培地成分、添加物等としてのみ使
用され、又は極めて高度な処理を受けていることにより、十分な感染因子のクリアランス
が確保され、感染症の罹患リスクが極めて低いものを除く。
)をいうものであること。例
えば、人の細胞組織等を原料等として用いる特定細胞加工物等として、ヒト血清アルブミ
ンを用いて製造した特定細胞加工物や他家のがん細胞等から抽出した mRNA を用いて製造
した特定核酸等(十分なウイルス不活化処理をして細胞から抽出された場合は除く。
)が
挙げられること。
(24)省令第 34 条第3項及び第4項関係
①
第4項について、多施設共同研究の継続中に、一の再生医療等提供機関において研
究を継続しないこととなった場合にも、当該医療機関は、自施設が研究を継続しない
こととなった日ではなく、研究全体が終了した日を起算日として、5年間記録を保存
すること。
②
第3項及び第4項について、再生医療等提供機関以外で委託業者や共同機関があ
る場合は、提供機関管理者の指導の下、委託業者や共同機関が当該再生医療等に関連
する記録を保存することもできる。この場合においては、研究計画書や契約において、
当該記録の保存について担保すること。
③
第3項の規定による省令第 27 条第8項第1号から第8号までに掲げる書類、再生
医療等を受ける者及び細胞提供者並びにこれらの代諾者に対する説明及びその同意
に係る文書並びに認定再生医療等委員会から受け取った審査等業務に係る文書並び
に第4項の規定による書類の保存については、
「厚生労働省の所管する法令の規定に
基づく民間事業者等が行う書面の保存等における情報通信の技術の利用に関する省
令」に基づく電磁的記録の保存を行うことができること。
(25)法第 17 条及び省令第 35 条関係
再生医療等提供機関の管理者は、法第 17 条の規定に基づき疾病等の報告の義務がある
ことから、同意説明文書において再生医療等提供機関の管理者が疾病等の報告の法的義
務を負っている旨を明記し、再生医療等の提供によるものと疑われる疾病、障害又は感染
症の症状の発生時又は当該疾病等が他院で治療された場合においても、速やかに当該再
生医療等を受けた者又はその家族等の代諾者等からの報告を受けられるように、事前に
40