よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関する法律施行令」、「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて[958KB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
なお、基本理念には、研究と治療で共通する内容も含まれているため、治療として再生
医療等を提供する場合にも、その一部を参照されたい。
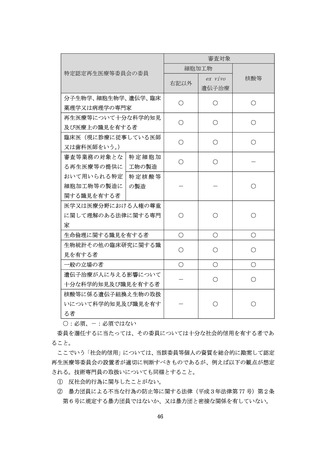
(16)省令第8条の3第1項関係
①
多施設共同研究を行う場合であっても、再生医療等の提供を行う各医療機関の管
理者は、各医療機関の再生医療等の提供の責務を担うこと。
②
代表管理者は、各再生医療等の提供を行う医療機関の管理者を代表して、再生医療
等提供計画の提出、疾病等報告等の手続を行うこと。代表管理者の選出方法や他の再
生医療等の提供を行う医療機関の管理者との役割分担については、当該再生医療等
の提供を行う医療機関の管理者間で決定して差し支えないが、その場合であっても、
それぞれの再生医療等の提供を行う医療機関の管理者が自身の医療機関における再
生医療等の責務を有すること。
(17)省令第8条の3第2項関係
①
情報共有の主な目的は、再発防止策の周知等を通じて、細胞提供者又は再生医療等
を受ける者の安全性を確保するためである。
② 「関連する必要な情報」とは、以下の情報その他の再生医療等を実施する上で共有
すべき必要な情報をいう。
(ア)モニタリング・監査の結果の報告の内容の通知を受けたときは、その内容
(イ)利益相反管理基準を定めたときはその旨
(ウ)主要評価項目報告書又は総括報告書の概要を公表したとき及び総括報告書の概
要を厚生労働大臣に提出したときはその旨
(エ)不適合であることを知ったときはその旨
(オ)認定再生医療等委員会の意見を述べられた場合には当該意見
(カ)再生医療等提供計画を提出したときはその旨
(キ)疾病等報告を行った場合はその旨
(ク)定期報告を行った場合はその旨
(18)省令第8条の4関係
①
研究計画書には、省令第8条の4に規定する事項のほか、研究の標題、それを特定
する番号及び作成日を記載すること。改訂が行われた場合には、改訂番号及び改訂日
を記載すること。改訂に当たっては、当該改訂後の研究計画書を施行する日を指定し、
法第5条第1項の変更に該当する場合は認定再生医療等委員会において再生医療等
提供基準への適合性を確認することが必要であり、全ての再生医療等の提供を行う
医療機関において当該施行日以降、改訂後の研究計画書に基づき研究を実施するこ
と。改訂番号の管理方法について疑義が生じた場合には、認定再生医療等委員会の意
見を聴くこと。
②
研究計画書の作成については、厚生労働省の所管する法令の規定に基づく民間事
業者等が行う書面の保存等における情報通信の技術の利用に関する省令に基づく電
17
医療等を提供する場合にも、その一部を参照されたい。
(16)省令第8条の3第1項関係
①
多施設共同研究を行う場合であっても、再生医療等の提供を行う各医療機関の管
理者は、各医療機関の再生医療等の提供の責務を担うこと。
②
代表管理者は、各再生医療等の提供を行う医療機関の管理者を代表して、再生医療
等提供計画の提出、疾病等報告等の手続を行うこと。代表管理者の選出方法や他の再
生医療等の提供を行う医療機関の管理者との役割分担については、当該再生医療等
の提供を行う医療機関の管理者間で決定して差し支えないが、その場合であっても、
それぞれの再生医療等の提供を行う医療機関の管理者が自身の医療機関における再
生医療等の責務を有すること。
(17)省令第8条の3第2項関係
①
情報共有の主な目的は、再発防止策の周知等を通じて、細胞提供者又は再生医療等
を受ける者の安全性を確保するためである。
② 「関連する必要な情報」とは、以下の情報その他の再生医療等を実施する上で共有
すべき必要な情報をいう。
(ア)モニタリング・監査の結果の報告の内容の通知を受けたときは、その内容
(イ)利益相反管理基準を定めたときはその旨
(ウ)主要評価項目報告書又は総括報告書の概要を公表したとき及び総括報告書の概
要を厚生労働大臣に提出したときはその旨
(エ)不適合であることを知ったときはその旨
(オ)認定再生医療等委員会の意見を述べられた場合には当該意見
(カ)再生医療等提供計画を提出したときはその旨
(キ)疾病等報告を行った場合はその旨
(ク)定期報告を行った場合はその旨
(18)省令第8条の4関係
①
研究計画書には、省令第8条の4に規定する事項のほか、研究の標題、それを特定
する番号及び作成日を記載すること。改訂が行われた場合には、改訂番号及び改訂日
を記載すること。改訂に当たっては、当該改訂後の研究計画書を施行する日を指定し、
法第5条第1項の変更に該当する場合は認定再生医療等委員会において再生医療等
提供基準への適合性を確認することが必要であり、全ての再生医療等の提供を行う
医療機関において当該施行日以降、改訂後の研究計画書に基づき研究を実施するこ
と。改訂番号の管理方法について疑義が生じた場合には、認定再生医療等委員会の意
見を聴くこと。
②
研究計画書の作成については、厚生労働省の所管する法令の規定に基づく民間事
業者等が行う書面の保存等における情報通信の技術の利用に関する省令に基づく電
17