よむ、つかう、まなぶ。
「規制改革実施計画」(令和4年6月7日 閣議決定) (88 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/publication/p_index.html |
| 出典情報 | 「規制改革実施計画」(令和4年6月7日閣議決定)(6/7)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
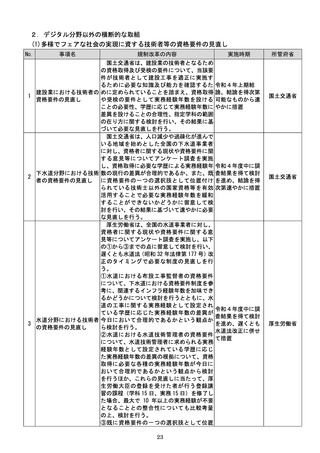
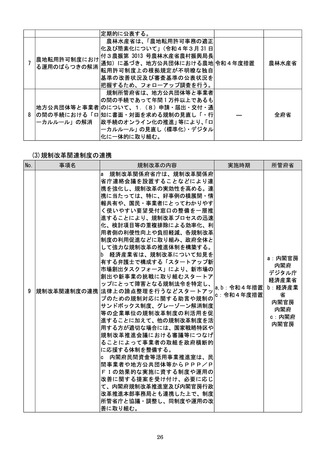
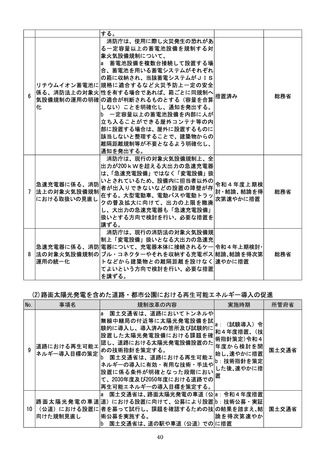
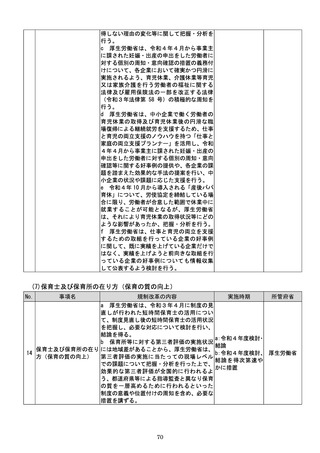
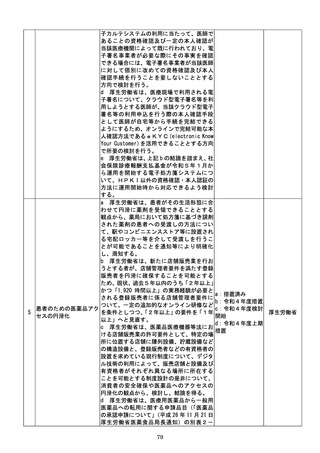
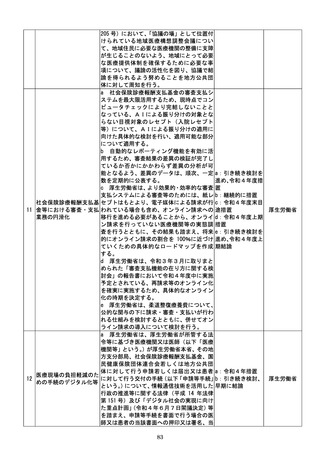
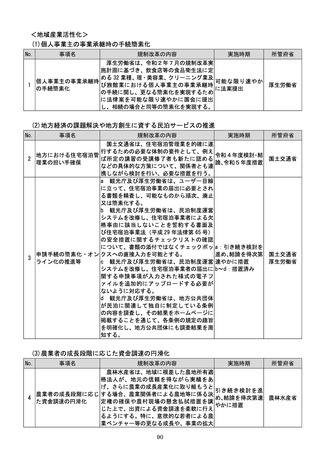
該書面の日本産業規格A列4番以外の大き
さ又は白以外の色による作成等によって医
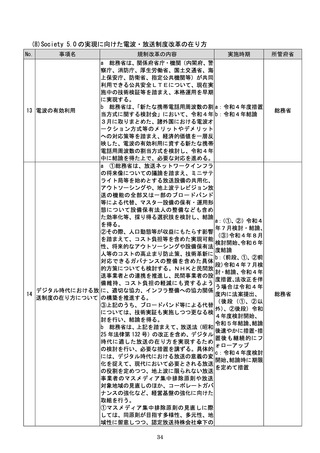
療機関等に生じる負担を軽減するため、医療
現場、地方公共団体その他の関係者の意見を
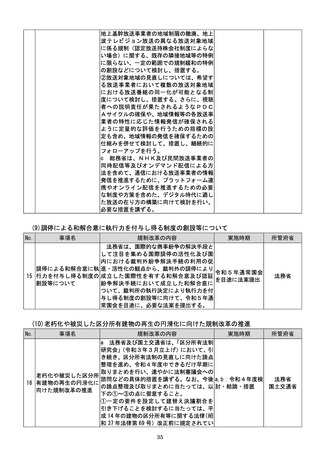
踏まえて相当の業務量が生じていると認め
られる申請等手続についてデジタル化(電子
メールにより申請等手続を行うことを含
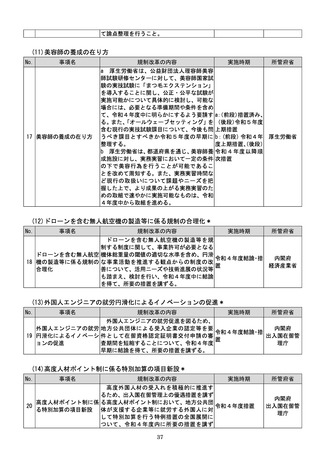
む。
)を進めるための工程表を作成する。当該
工程表には、申請等手続のデジタル化のみな
らず、書面による作成を求める場合の医療機
関等の負担軽減に関する方策を含むものと
し、署名又は押印の廃止や、その廃止を困難
とする場合に署名又は押印を印刷印影又は
組織印に代えることの可否に関する内容を
含むものとする。
b 厚生労働省は、電子処方箋以外の医療現場
での書類について、デジタル化によって、医
療従事者の負担軽減等を実現する観点から、
電子署名の要否等について整理を行う。
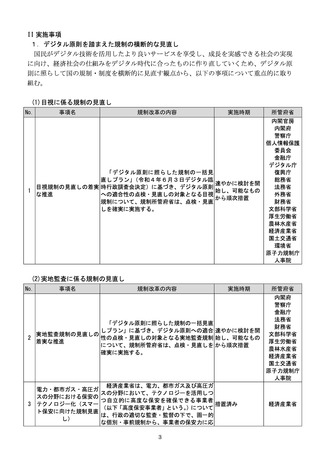
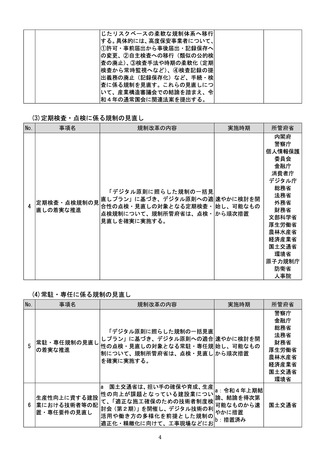
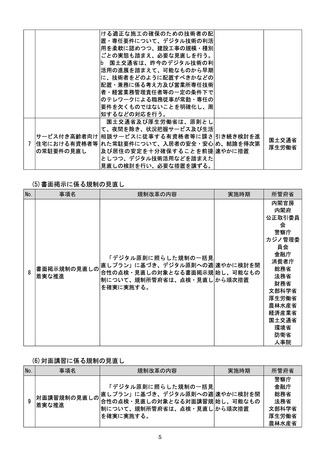
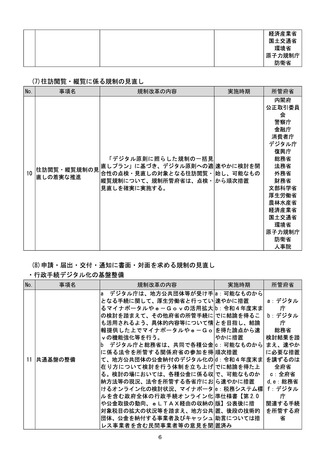
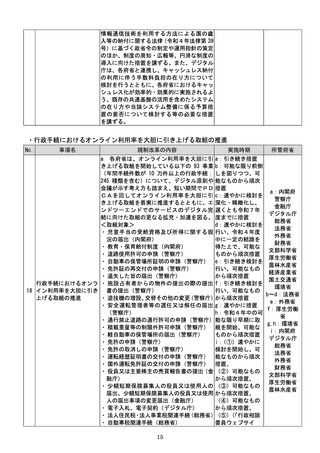
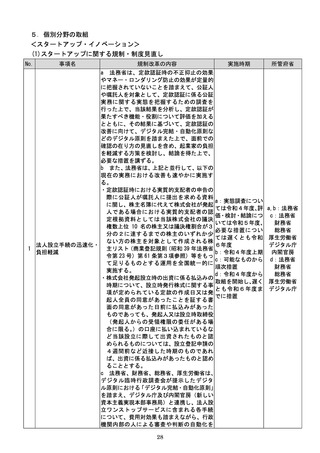
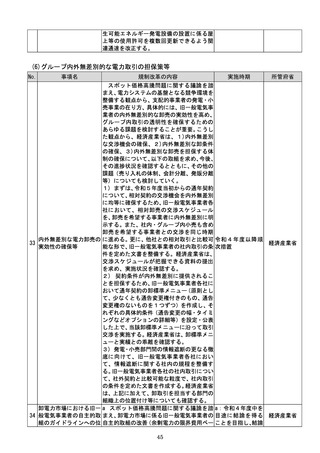
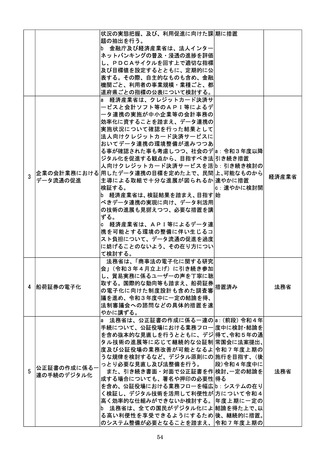
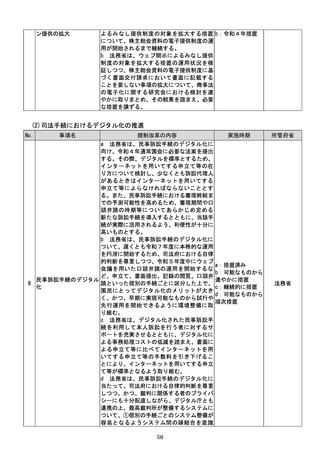
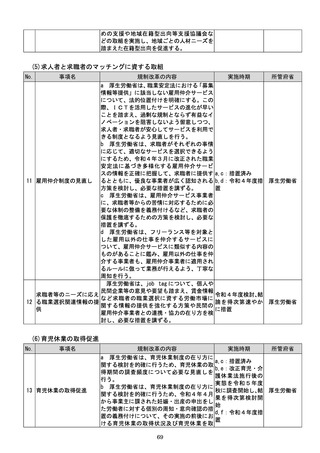
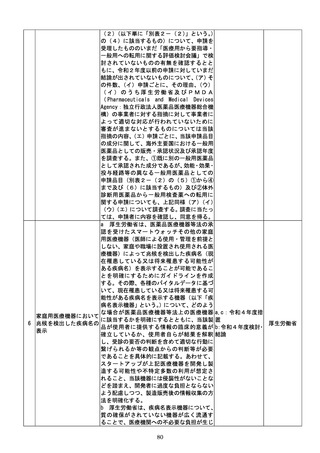
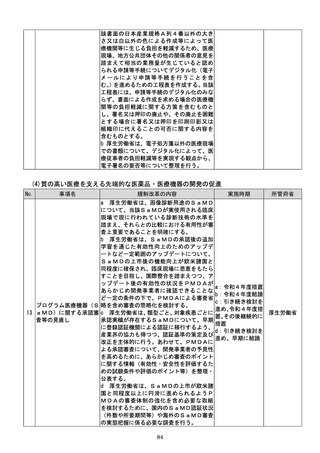
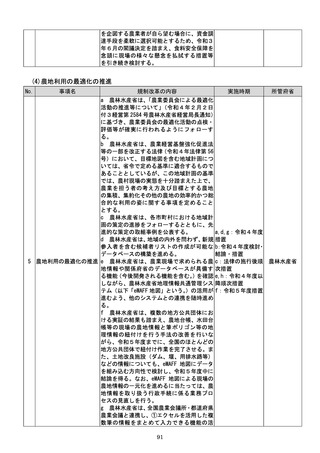
(4)質の高い医療を支える先端的な医薬品・医療機器の開発の促進
No.
事項名
規制改革の内容
実施時期
所管府省
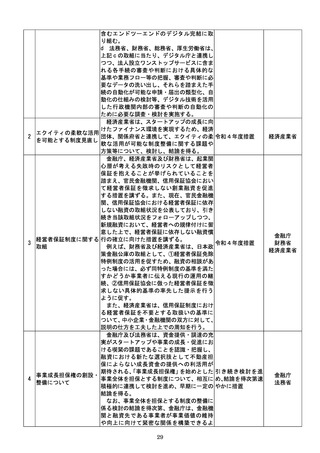
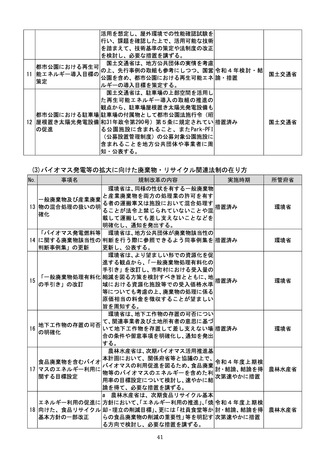
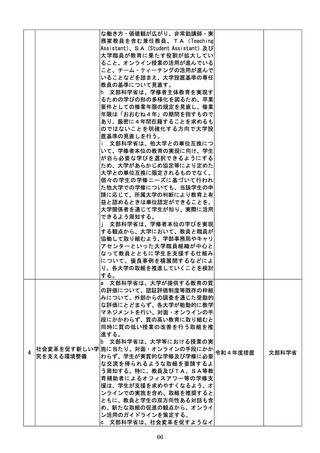
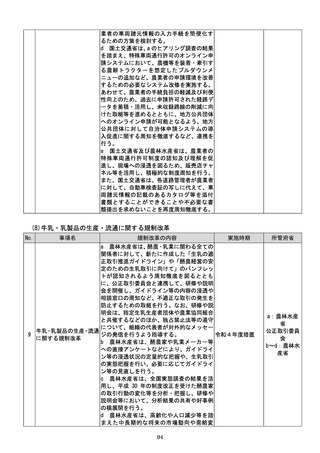
a 厚生労働省は、画像診断用途のSaMD
について、当該SaMDが実使用される臨床
現場で現に行われている診断技術の水準を
踏まえ、それらとの比較における有用性が審
査上重要であることを明確にする。
b 厚生労働省は、SaMDの承認後の追加
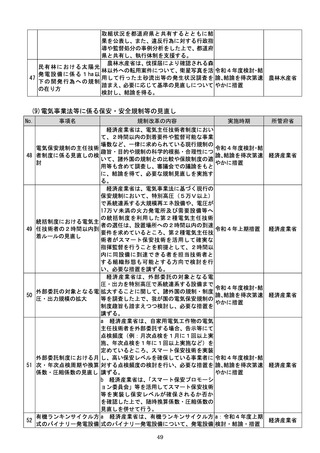
学習を通じた有効性向上のためのアップデ
ートなど一定範囲のアップデートについて、
SaMDの上市後の機能向上が欧米諸国と
同程度に確保され、臨床現場に恩恵をもたら
すことを目指し、国際整合を踏まえつつ、ア
ップデート後の有効性の状況をPMDAが
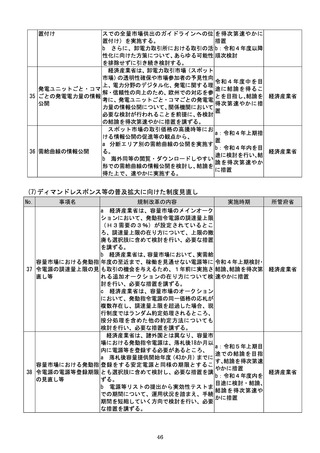
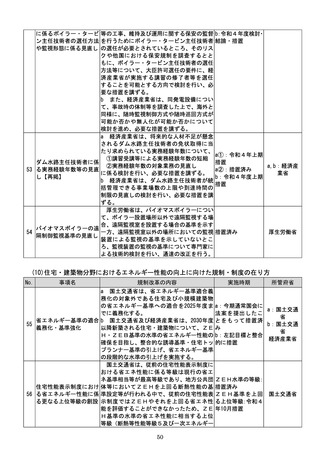
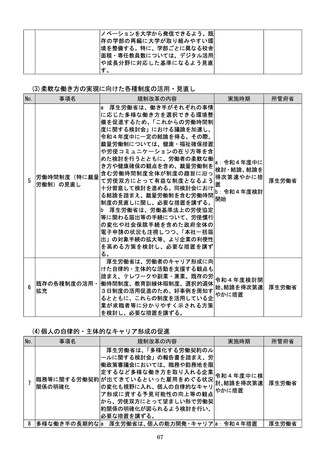
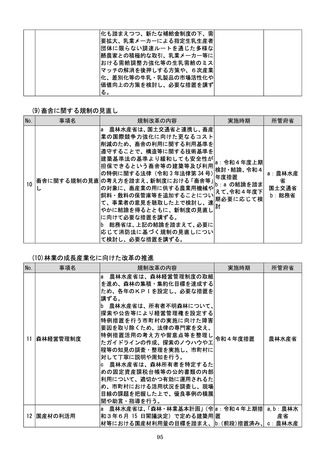
a:令和4年度措置
あらかじめ開発事業者に確認できることな
b:令和4年度結論
ど一定の条件の下で、PMDAによる審査省
c:引き続き検討を
プログラム医療機器(S 略を含め審査の簡略化を検討する。
進め、令和4年度措
13 aMD)に関する承認審 c 厚生労働省は、類型ごと、対象疾患ごとに
厚生労働省
置、その後継続的に
査等の見直し
承認実績が存在するSaMDについて、早期
措置
に登録認証機関による認証に移行するよう、
d:引き続き検討を
産業界の協力も得つつ、認証基準の策定及び
進め、早期に結論
改正を主体的に行う。あわせて、PMDAに
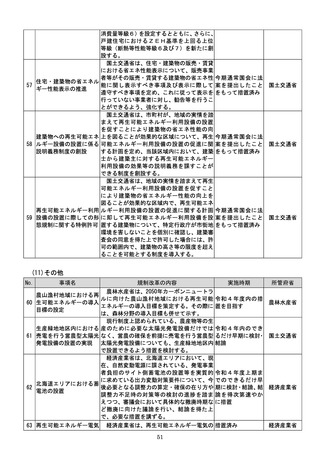
よる承認審査について、開発事業者の予見性
を高めるために、あらかじめ審査のポイント
に関する情報(有効性・安全性を評価するた
めの試験条件や評価のポイント等)を整理・
公表する。
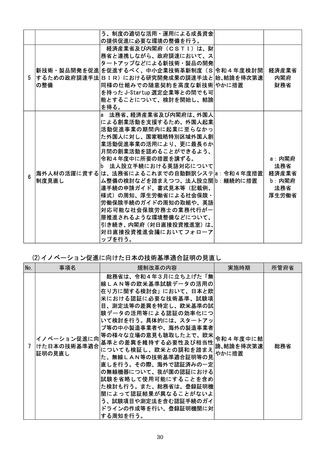
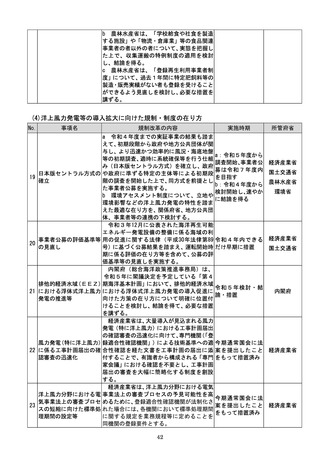
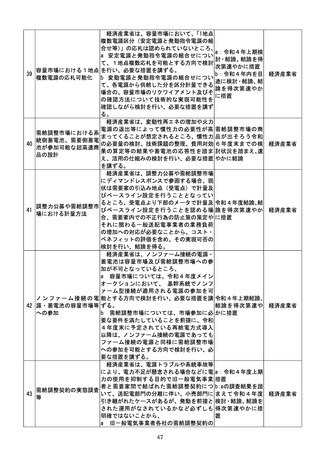
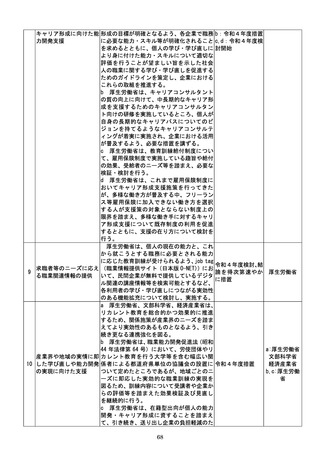
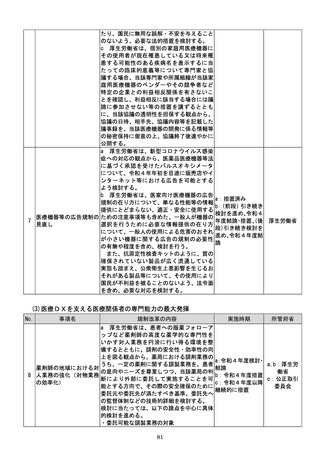
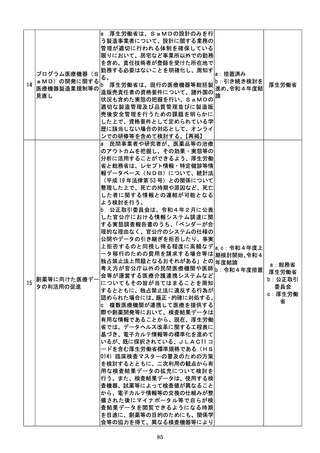
d 厚生労働省は、SaMDの上市が欧米諸
国と同程度以上に円滑に進められるようP
MDAの審査体制の強化を含め必要な取組
を検討するために、国内のSaMD認証状況
(件数や所要期間等)や海外のSaMD審査
の実態把握に係る必要な調査を行う。
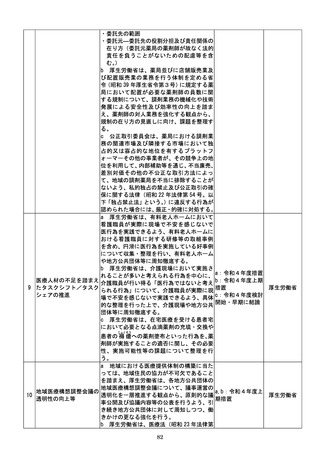
84
さ又は白以外の色による作成等によって医
療機関等に生じる負担を軽減するため、医療
現場、地方公共団体その他の関係者の意見を
踏まえて相当の業務量が生じていると認め
られる申請等手続についてデジタル化(電子
メールにより申請等手続を行うことを含
む。
)を進めるための工程表を作成する。当該
工程表には、申請等手続のデジタル化のみな
らず、書面による作成を求める場合の医療機
関等の負担軽減に関する方策を含むものと
し、署名又は押印の廃止や、その廃止を困難
とする場合に署名又は押印を印刷印影又は
組織印に代えることの可否に関する内容を
含むものとする。
b 厚生労働省は、電子処方箋以外の医療現場
での書類について、デジタル化によって、医
療従事者の負担軽減等を実現する観点から、
電子署名の要否等について整理を行う。
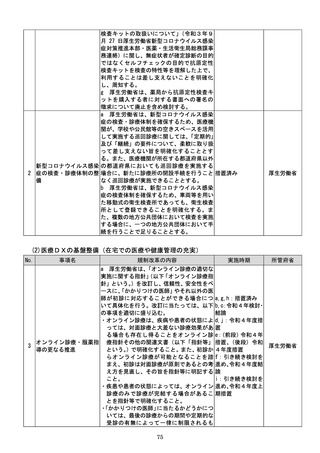
(4)質の高い医療を支える先端的な医薬品・医療機器の開発の促進
No.
事項名
規制改革の内容
実施時期
所管府省
a 厚生労働省は、画像診断用途のSaMD
について、当該SaMDが実使用される臨床
現場で現に行われている診断技術の水準を
踏まえ、それらとの比較における有用性が審
査上重要であることを明確にする。
b 厚生労働省は、SaMDの承認後の追加
学習を通じた有効性向上のためのアップデ
ートなど一定範囲のアップデートについて、
SaMDの上市後の機能向上が欧米諸国と
同程度に確保され、臨床現場に恩恵をもたら
すことを目指し、国際整合を踏まえつつ、ア
ップデート後の有効性の状況をPMDAが
a:令和4年度措置
あらかじめ開発事業者に確認できることな
b:令和4年度結論
ど一定の条件の下で、PMDAによる審査省
c:引き続き検討を
プログラム医療機器(S 略を含め審査の簡略化を検討する。
進め、令和4年度措
13 aMD)に関する承認審 c 厚生労働省は、類型ごと、対象疾患ごとに
厚生労働省
置、その後継続的に
査等の見直し
承認実績が存在するSaMDについて、早期
措置
に登録認証機関による認証に移行するよう、
d:引き続き検討を
産業界の協力も得つつ、認証基準の策定及び
進め、早期に結論
改正を主体的に行う。あわせて、PMDAに
よる承認審査について、開発事業者の予見性
を高めるために、あらかじめ審査のポイント
に関する情報(有効性・安全性を評価するた
めの試験条件や評価のポイント等)を整理・
公表する。
d 厚生労働省は、SaMDの上市が欧米諸
国と同程度以上に円滑に進められるようP
MDAの審査体制の強化を含め必要な取組
を検討するために、国内のSaMD認証状況
(件数や所要期間等)や海外のSaMD審査
の実態把握に係る必要な調査を行う。
84