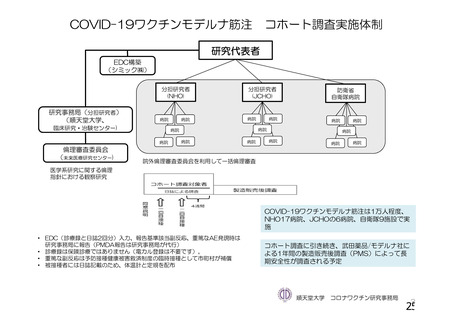
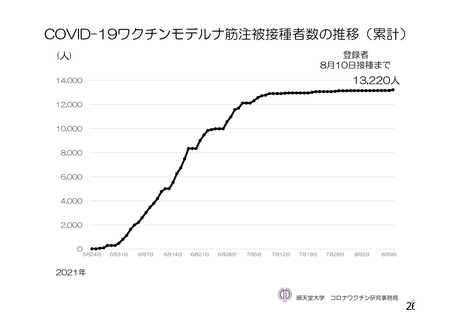
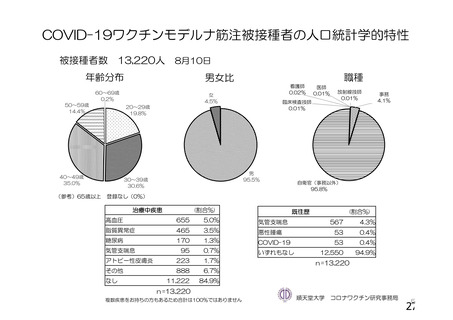
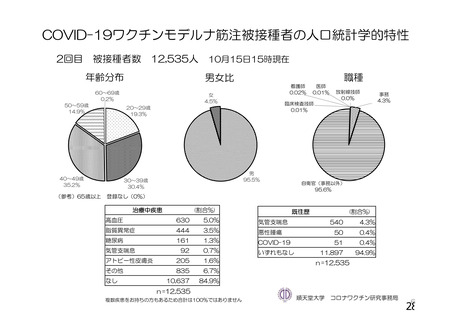
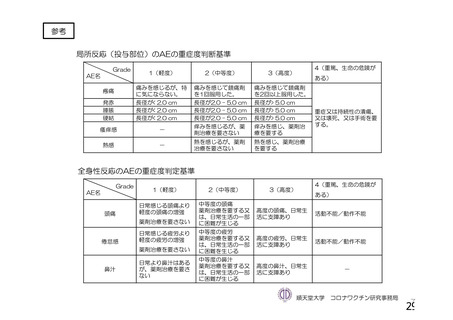
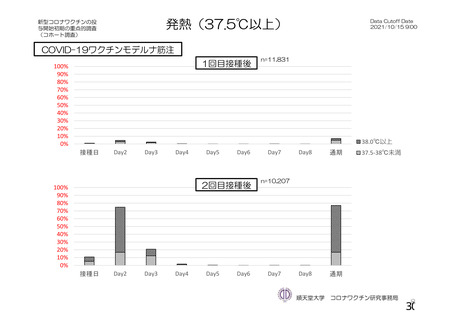
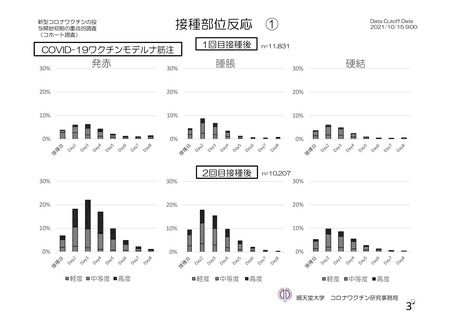
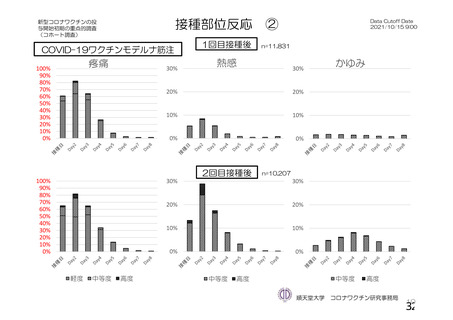
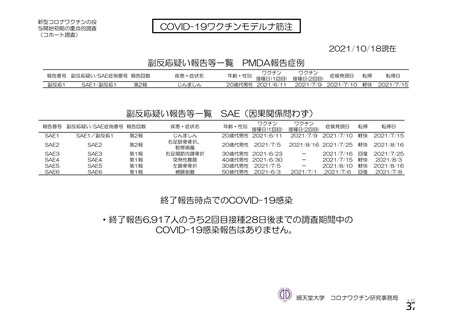
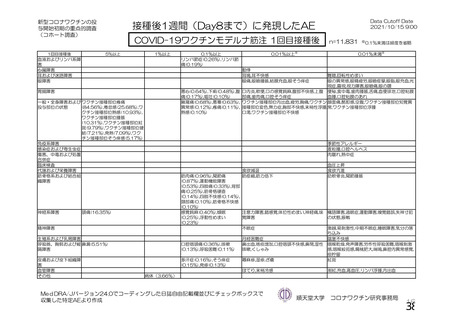
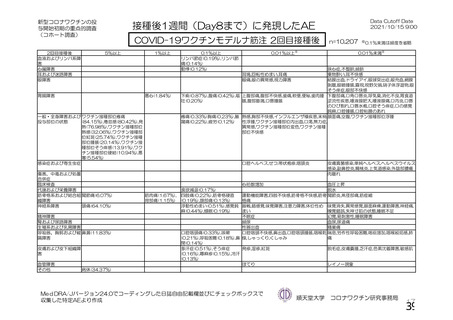
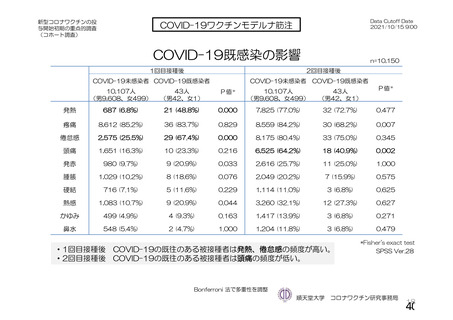
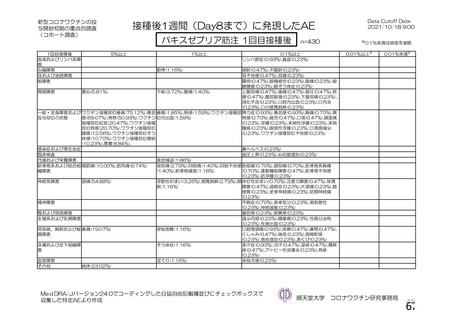
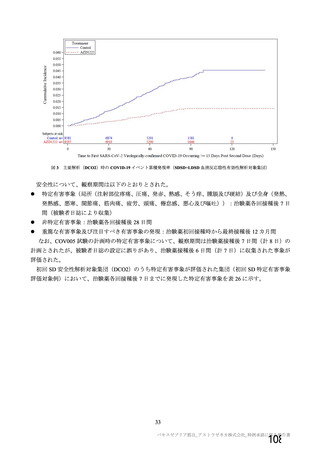
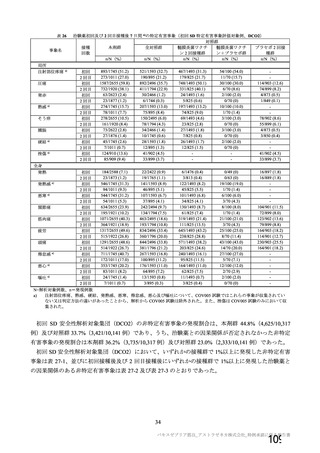
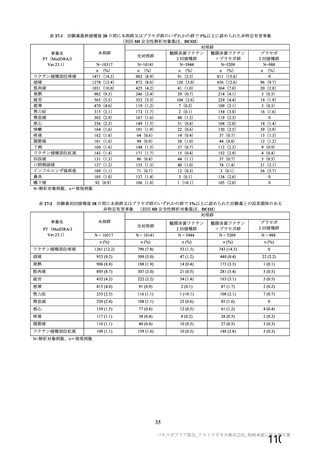
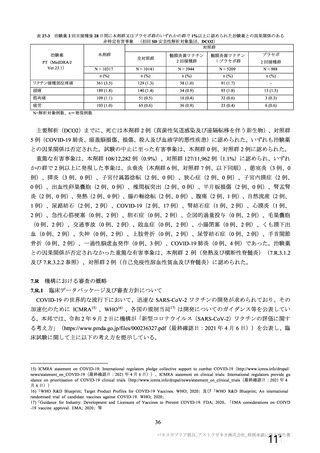
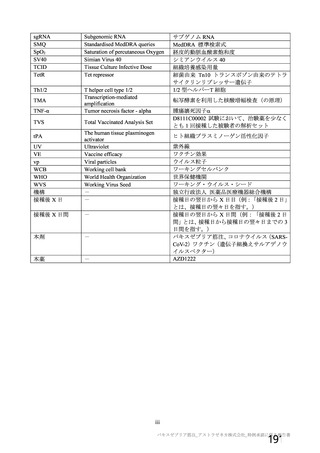
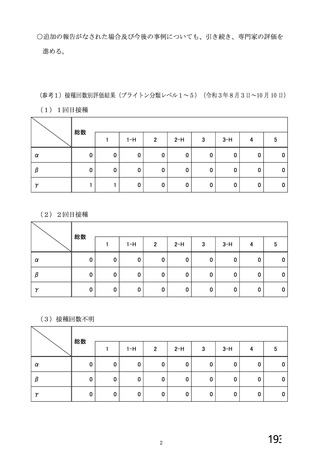
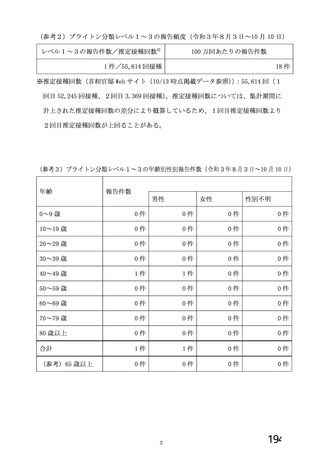
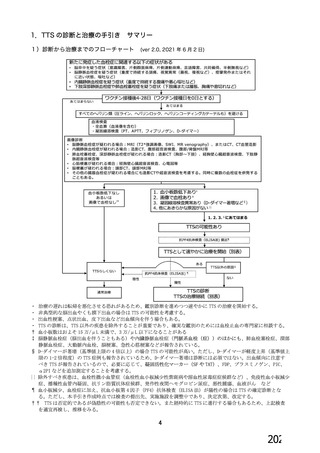
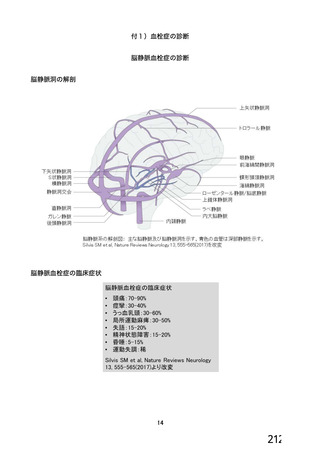
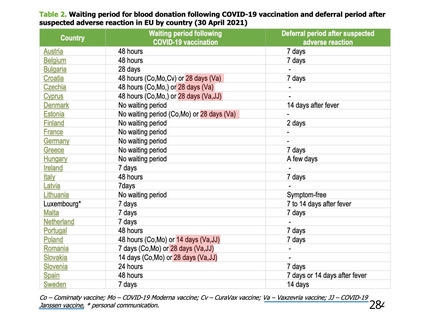
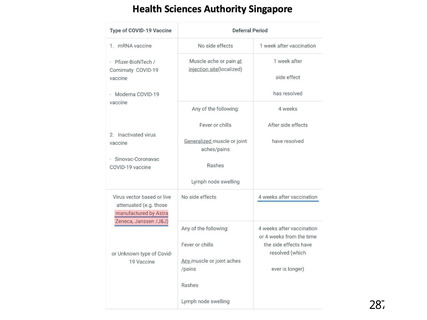
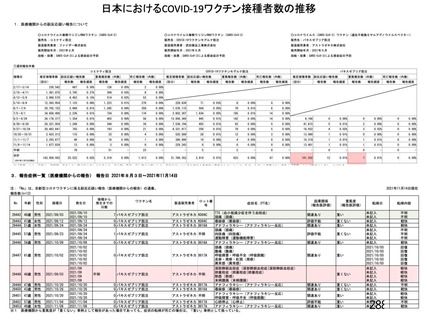
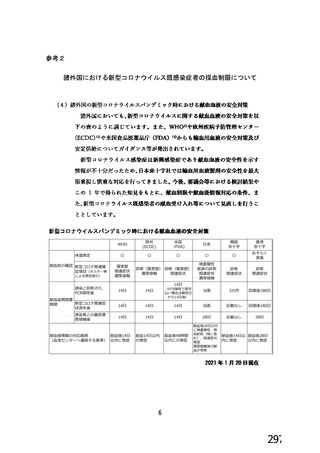
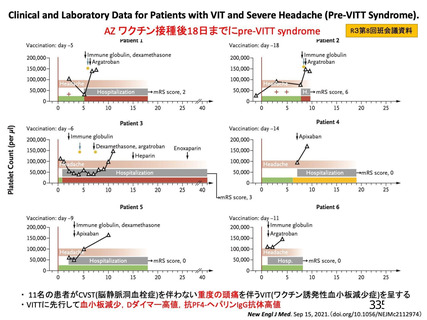
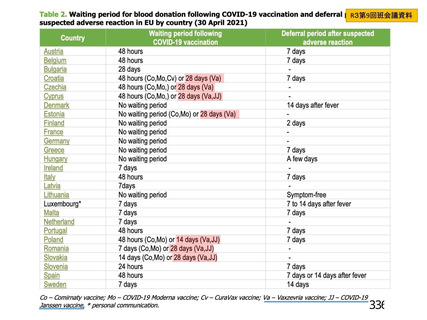
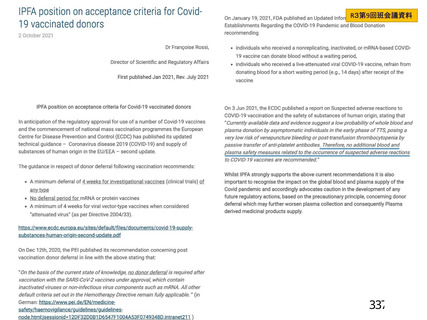
資 料4-1 令和3年度第6回安全技術調査会の審議結果について (250 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
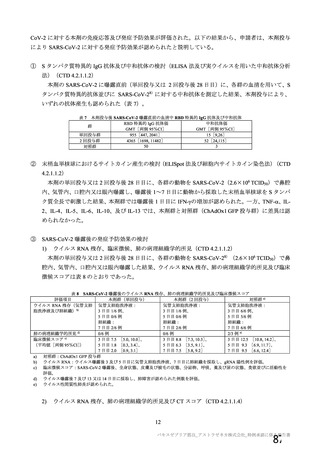
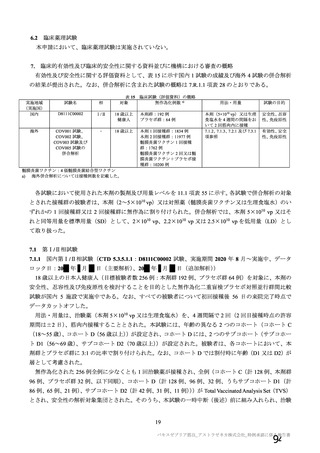
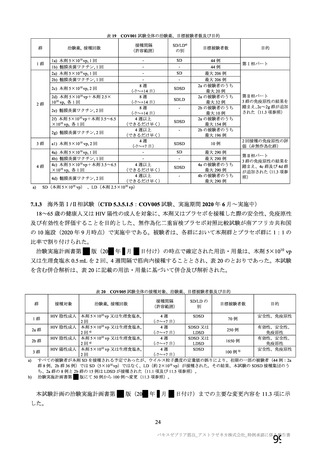
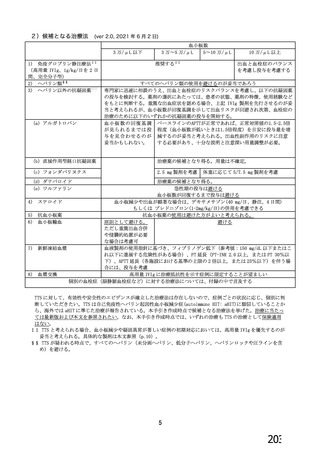
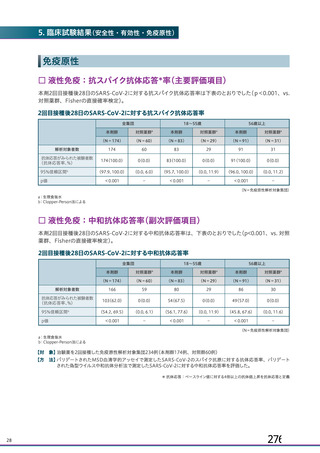
18.薬効薬理
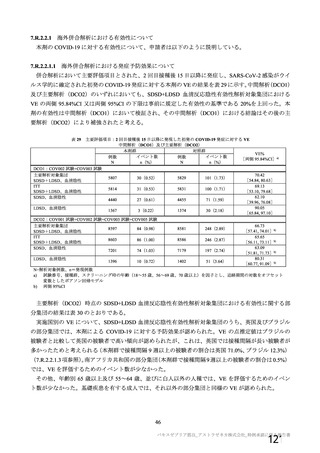
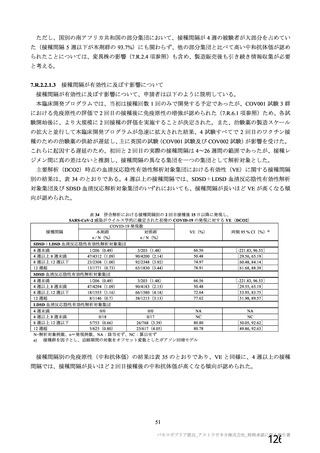
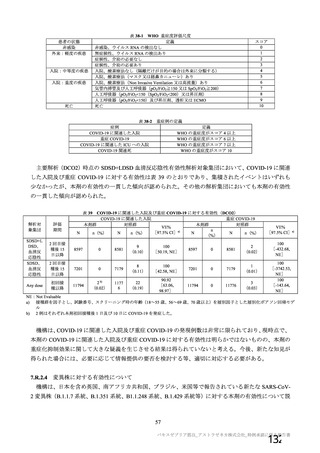
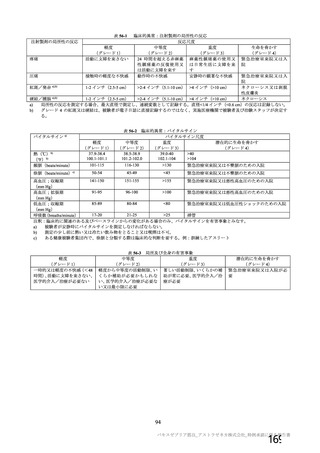
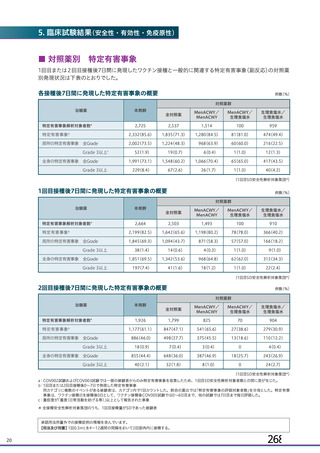
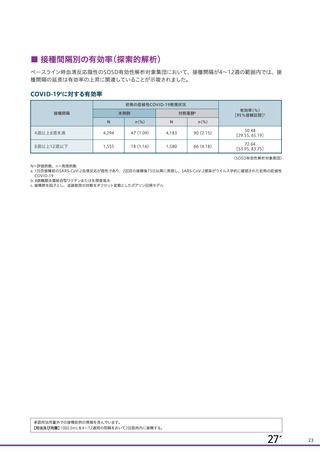
主要解析)
が20%以上の事象及び発熱b)、
18.
1 作用機序
本剤は、単一組換え型1価ワクチンであり、SARSCoV2のスパイク糖タン
発現例数[発現割合(%)
]
本剤群
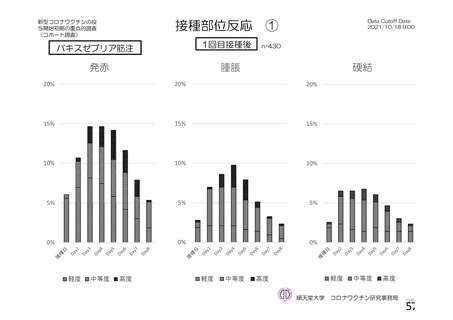
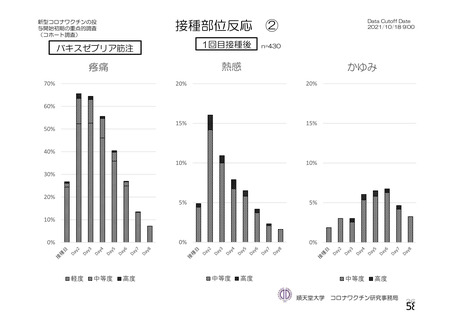
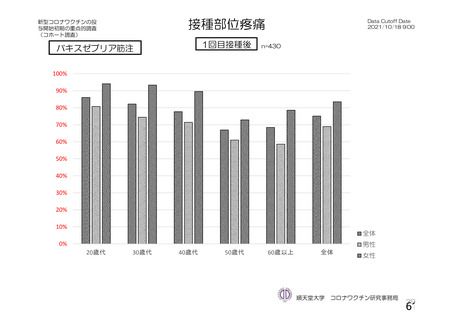
注射部
位圧痛
注射部
位仏痛
接種
評価
回数
例数d)
1
2,
655
2
1,
920
1
1,
745
2
1
1,
011
2,
655
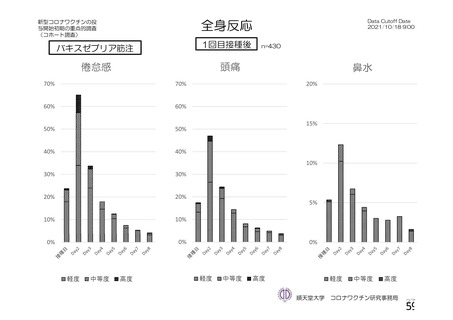
疲労
2
1,
922
1
2,
655
2
1,
922
頭痛
1
1,
745
2
1,
011
倦怠感
1
2,
655
筋肉痛
2
1,
921
1
1,
745
2
011
1,
発熱感f)
1
1,
745
2
1,
011
悪寒
1
2,
655
2
1,
921
関節痛
1
1,
745
悪心
2
1,
011
1
2,
588
2
1,
873
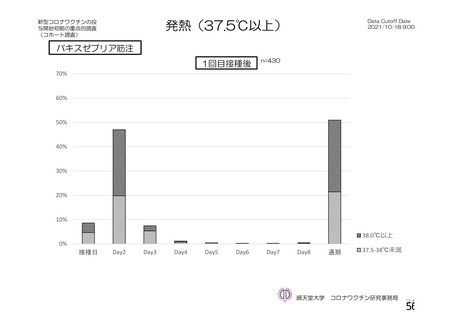
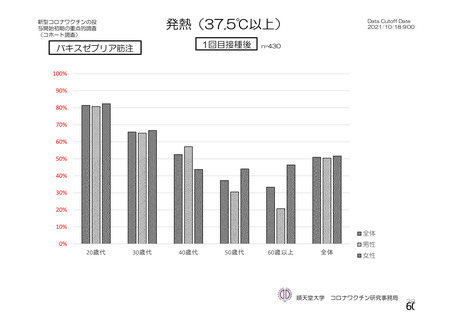
発熱g)
全体
1,
587
(
59.
8)
732
(
38.
1)
893
(
51.
2)
Gr
ade3
評価
以上e)
例数d)
25 (
0.
9) 2,
496
14 (
0.
7) 1,
794
9(
0.
5) 1,
593
273
0
(
27.
0)
1,
317
(
49.
6)
515
(
26.
8)
1,
291
(
48.
6)
514
(
26.
7)
711
(
40.
7)
172
(
17.
0)
1,
071
(
40.
3)
364
(
18.
9)
546
(
31.
3)
94
(
9.
3)
544
(
31.
2)
54
(
5.
3)
634
(
23.
9)
195
(
10.
2)
353
(
20.
2)
83
(
8.
2)
184
(
7.
1)
23
(
1.
2)
パク質の遺伝子を組み込んだ非増殖性のチンパンジーアデノウイルス
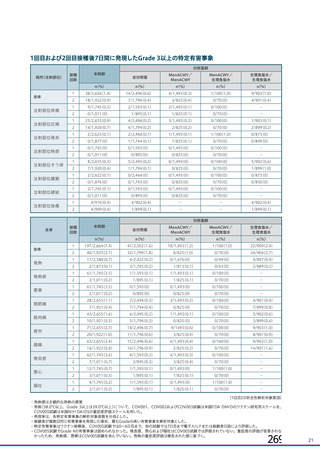
対照薬群c)
895
71 (
2.
7) 2,
496
20 (
1.
0) 1,
796
63 (
2.
4) 2,
496
16 (
0.
8) 1,
796
62 (
3.
6) 1,
593
7(
0.
7)
895
43 (
1.
6) 2,
495
10 (
0.
5) 1,
794
全体
892
(
35.
7)
411
(
22.
9)
521
(
32.
7)
190
(
21.
2)
834
(
33.
4)
360
(
20.
0)
844
(
33.
8)
381
(
21.
2)
267
(
16.
8)
100
(
11.
2)
463
(
18.
6)
193
(
10.
8)
141
61 (
3.
5) 1,
593
2(
0.
2)
(
8.
9)
46
895
(
5.
1)
2(
0.
2)
242
(
9.
7)
134
3(
0.
3)
(
7.
5)
176
(
11.
0)
895
17 (
0.
7) 2,
422
2(
0.
1) 1,
765
64
(
7.
2)
22
(
0.
9)
19
(
1.
1)
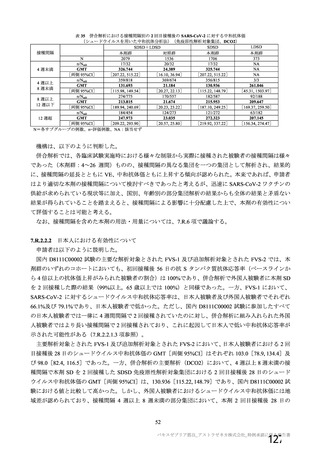
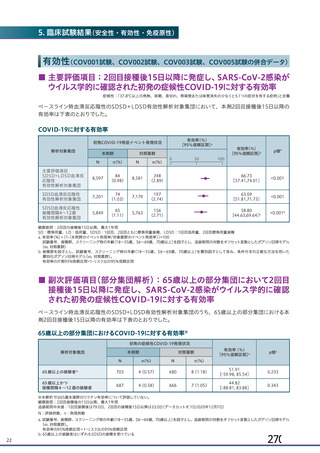
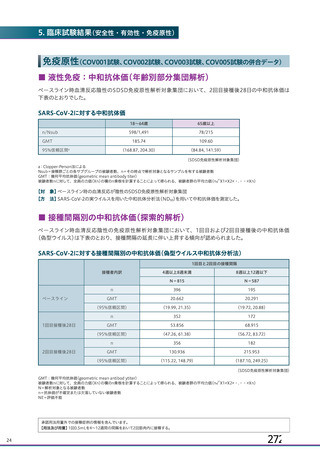
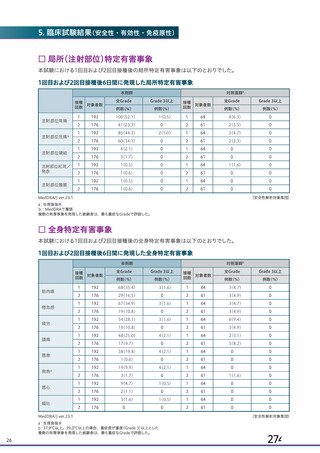
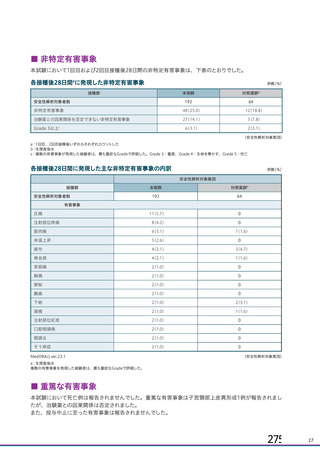
20.取扱い上の注意
20.
1本剤は激しく振盪しないこと。
20.
2本剤は凍結を避け、
凍結した場合は使用しないこと。
20.
3外箱開封後は遮光して保存すること。
2(
0.
1)
21.承認条件
1(
0.
1)
21.
1医薬品リスク管理計画を策定の上、
適切に実施すること。
21.
2現時点での知見が限られていることから、製造販売後、副反応情報等の
本剤の安全性に関するデータを、あらかじめ定めた計画に基づき早期に収
18 (
0.
7)
集するとともに、独立行政法人医薬品医療機器総合機構に提出し、本剤の適
正使用に必要な措置を講じること。その際、国が実施する健康調査等により
11 (
0.
6)
得られた情報についても適切に反映すること。
21.
3現在国内外で実施中又は計画中の臨床試験の成績が得られた際には、速
15 (
0.
6)
やかに当該成績を独立行政法人医薬品医療機器総合機構に提出するととも
16 (
0.
9)
が容易に入手可能となるよう必要な措置を講じること。また、国が行う本剤
に、本剤の有効性及び安全性に係る最新の情報を、医療従事者及び被接種者
の有効性及び安全性に係る情報の発信について、
適切に協力すること。
4(
0.
3)
21.
4本剤は、医薬品医療機器等法第14条の3第1項の規定に基づき承認され
た特例承認品目であり、承認時において長期安定性等に係る情報は限られ
ているため、
製造販売後も引き続き情報を収集し、
報告すること。
3(
0.
3)
21.
5本剤の接種に際し、本剤の有効性及び安全性については今後も情報が集
積されることを踏まえ、あらかじめ被接種者又は代諾者に最新の有効性及
6(
0.
2)
び安全性に関する情報が文書をもって説明され、予診票等で文書による同
5(
0.
3)
意を得てから接種されるよう、
医師に対して適切に説明すること。
21.
6医薬品医療機器等法施行規則第41条に基づく資料の提出の猶予期間は、
承認取得から起算して6カ月とする。上記に基づいて提出された資料等によ
1(
0.
1)
り、承認事項を変更する必要が認められた場合には、医薬品医療機器等法第
74条の2第3項に基づき承認事項の変更を命ずることがあること。
1(
0.
1)
22.包装
バイアル5mL:1本又は2本
0
23.主要文献
37
7(
0.
4) 1,
794
12 (
0.
7) 1,
593
4(
0.
2)
0
(
4.
1)
28 (
1.
1) 2,
494
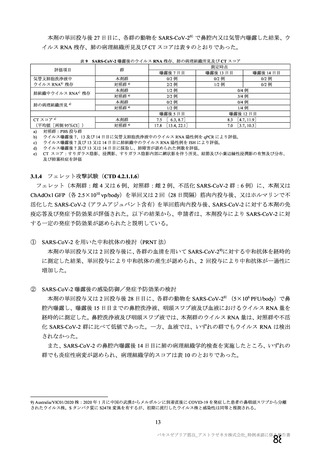
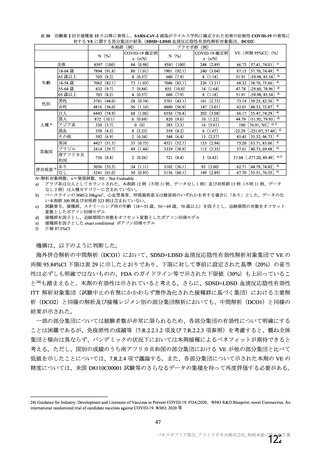
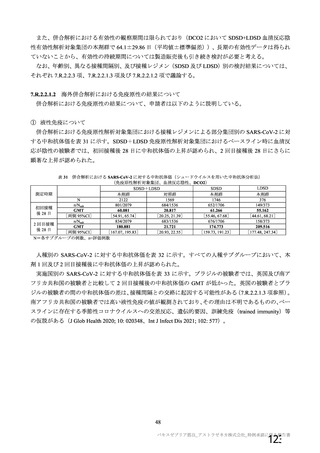
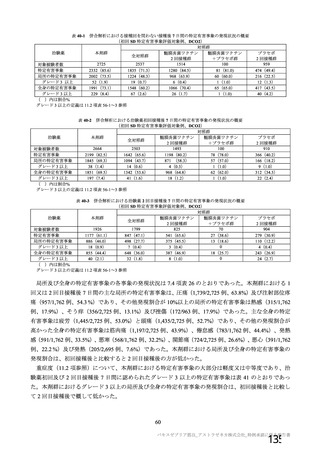
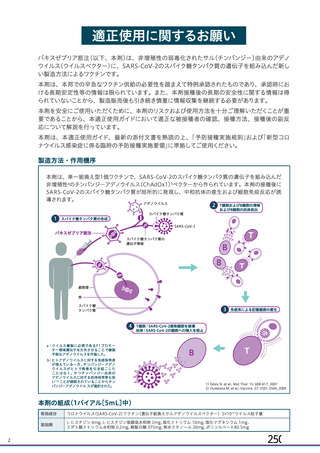
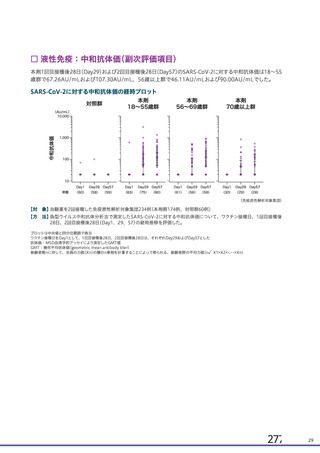
中和抗体の産生及び細胞免疫反応が誘導される。
4(
0.
2)
(
6.
7)
895
本剤の接種後にSARSCoV2のスパイク糖タンパク質が局所的に発現し、
以上e)
107
61 (
3.
5) 1,
593
(ChAdOx1)
ベクターから成る。
Gr
ade3
1)
Gr
ei
nacherA,etal
.N EnglJMed.2021 Apr9.
2)Scul
l
yM,etal
.N EnglJMed.2021 Apr16.
7(
0.
3)
3)
社内資料:国内第I
/I
I
相試験(D8111C00002試験)
(2021年5月21日承
7(
0.
4)
eyM,etal
.Lancet
.2021;
397(
4)Voys
10277)
:
881891.
認、
CTD2.
7.
6.
2)
1(
0.
1)
24.文献請求先及び問い合わせ先
アストラゼネカ株式会社メディカルインフォメーションセンター
〒5300011 大阪市北区大深町3番1号
1)
1(
0.
TEL 0120189115
ht
t
ps
:
/
/
www.
as
t
r
azeneca.
co.
j
p
4(
0.
2)
25.保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)
。
3(
0.
2)
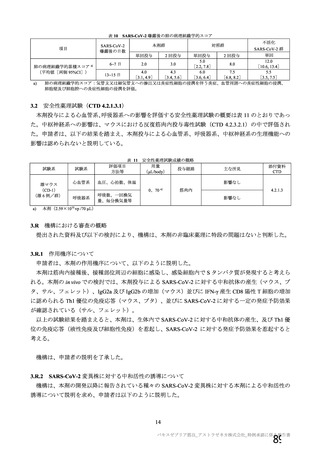
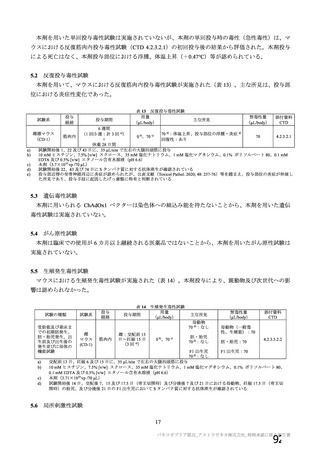
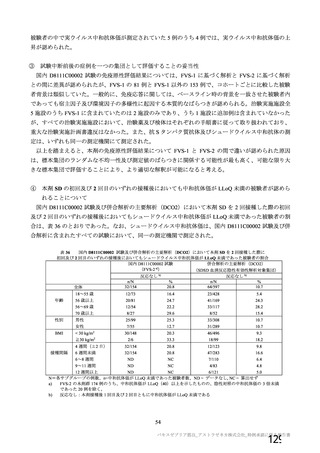
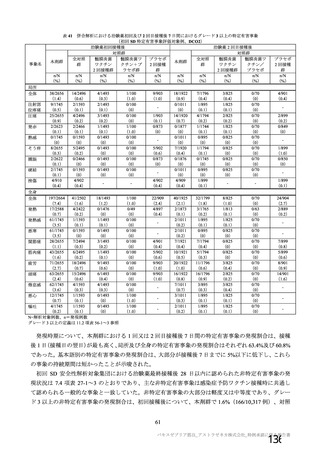
SD:標準用量を1回接種、SDLD:1回目標準用量及び2回目低用量を接種、
SDSD:標準用量を2回接種
26.製造販売業者等
26.
1 製造販売元
a)COV005試験のみ接種後6日間
アストラゼネカ株式会社
b)本剤の発現割合が20%未満であるが参考として含めた
大阪市北区大深町3番1号
26.
2 供給提携
c)4価髄膜炎菌結合型ワクチン又は生理食塩水
d)初回標準用量(5×1010 vp)を接種した被験者(SD、SDSD及びSDLDレジ
メン※)
Mei
j
iSei
ka ファルマ株式会社
東京都中央区京橋2416
e)重症度が「重度(日常活動を妨げる等)
」
以上として報告された事象
f
)主観的な発熱の感覚
g)38.
0℃以上。39.
0℃(COV005試験のみ39.
3℃)以上の場合、重症度が重度
(Gr
ade3)
以上とした
※ 本剤の承認用法用量はSDSDである
PI
900̲
01
−4−
248