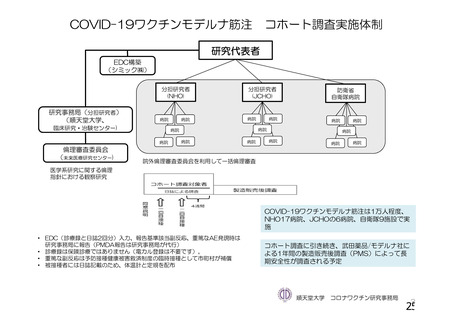
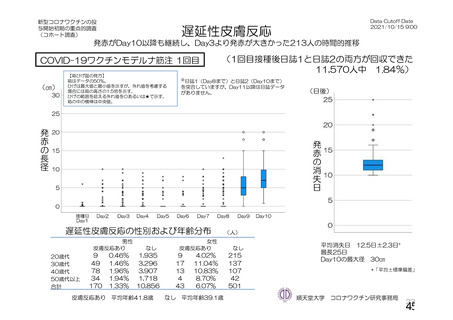
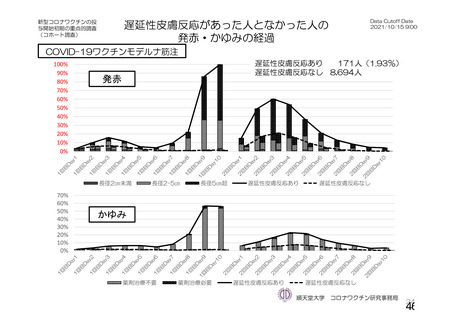
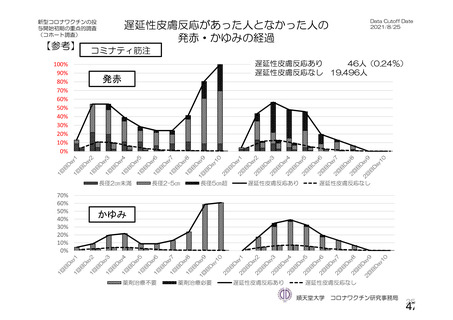
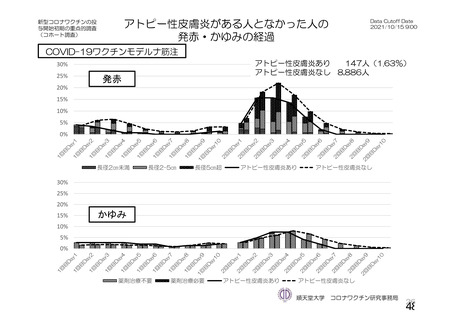
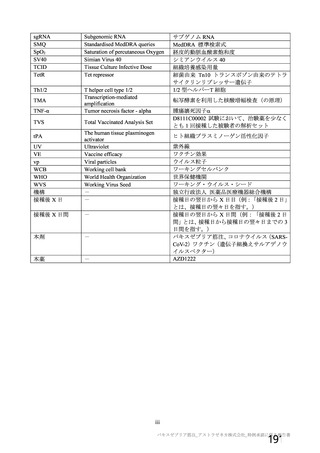
資 料4-1 令和3年度第6回安全技術調査会の審議結果について (142 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
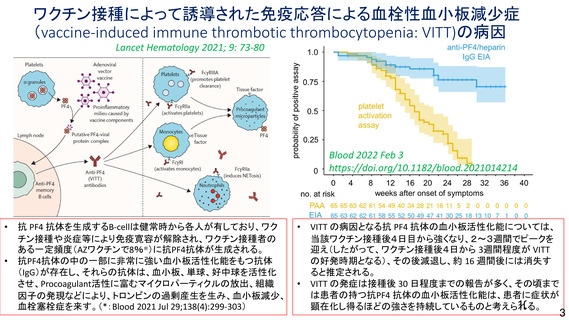
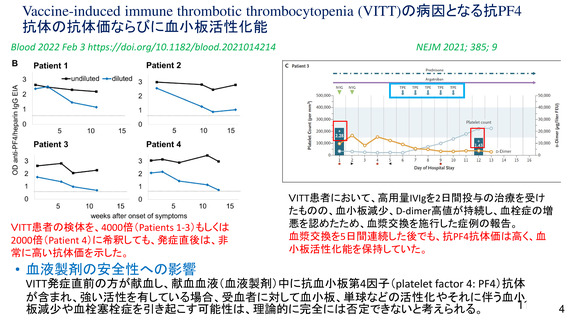
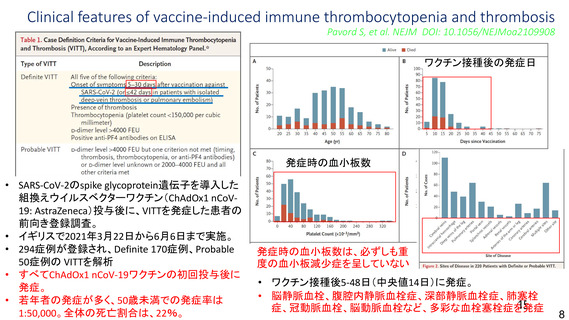
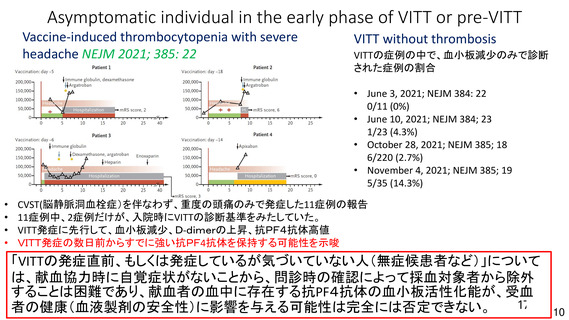
とは関連性がないと考える。
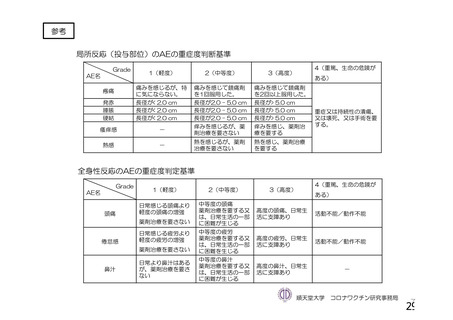
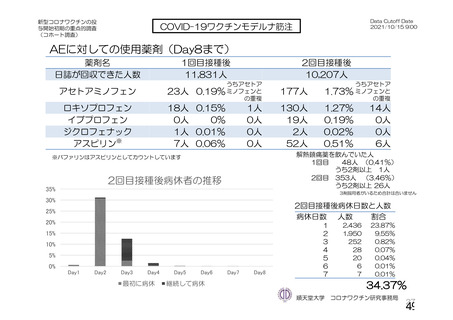
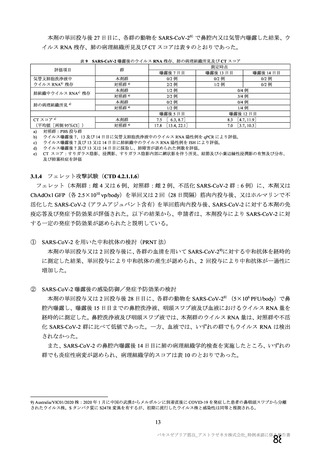
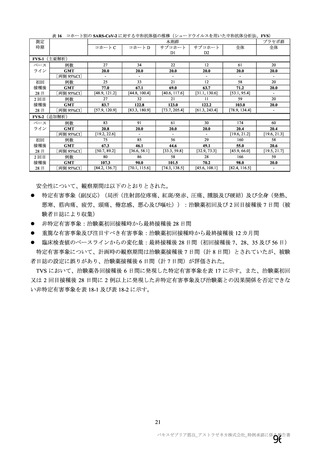
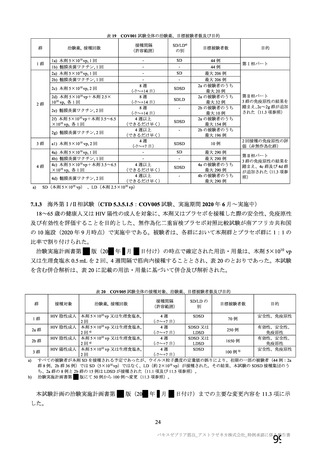
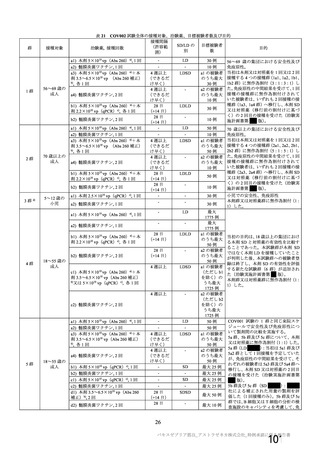
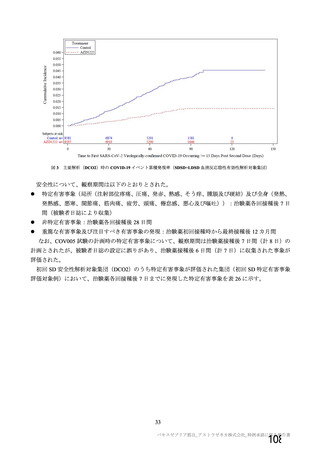
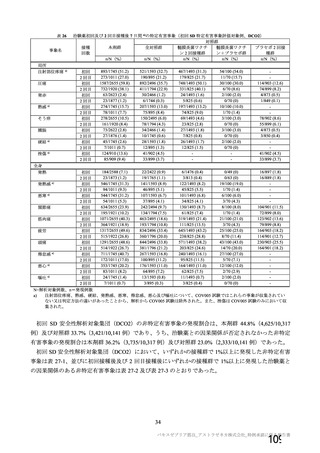
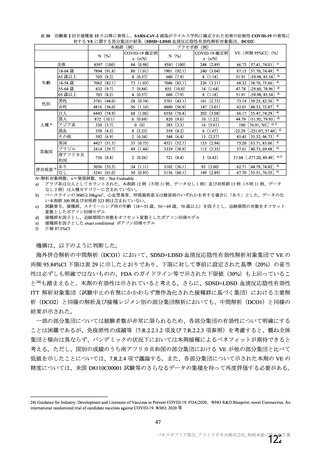
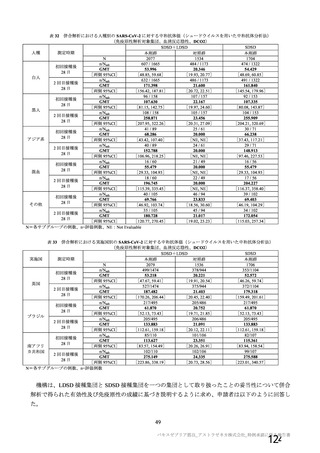
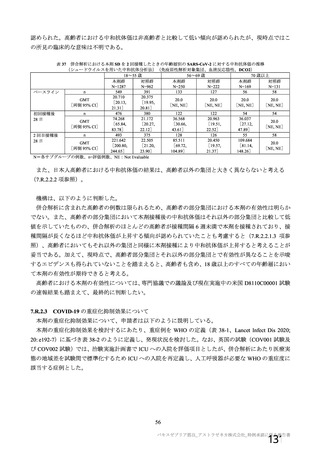
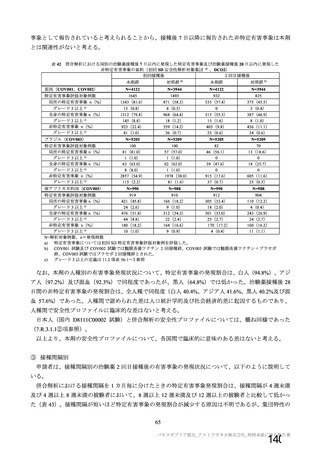
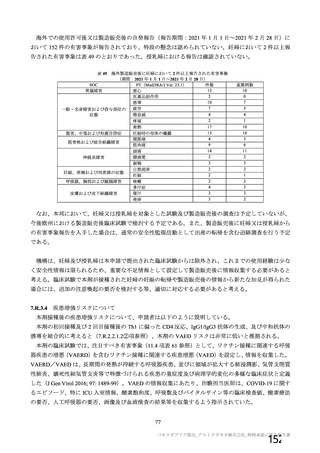
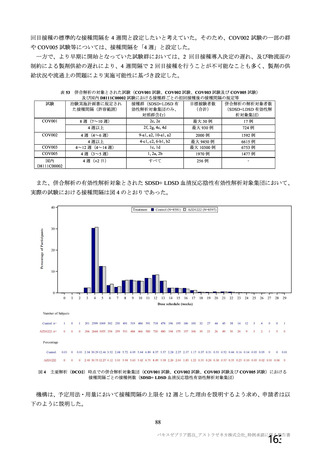
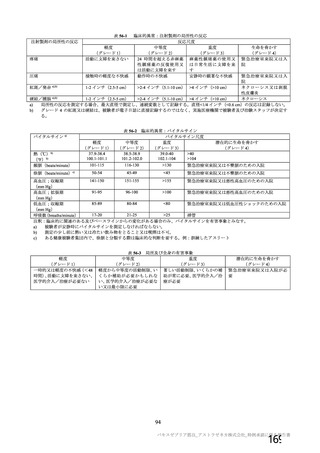
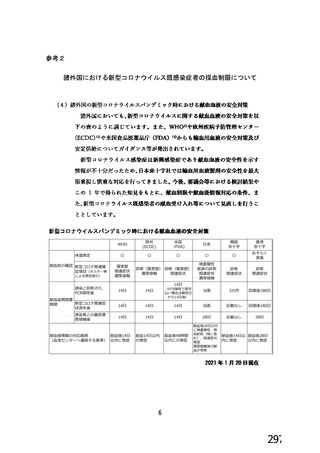
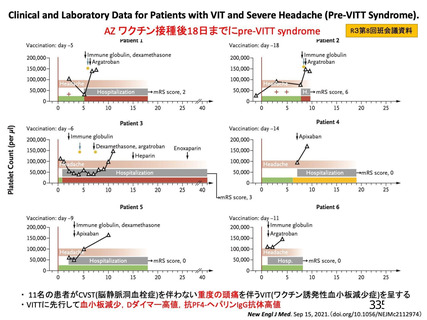
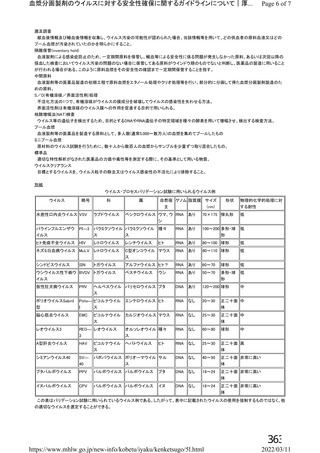
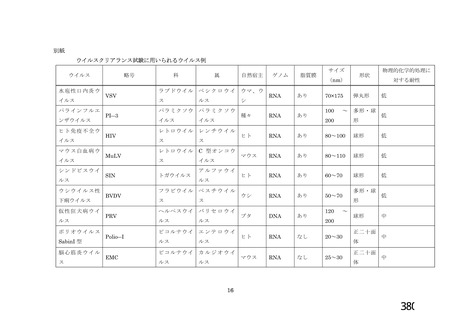
表 42
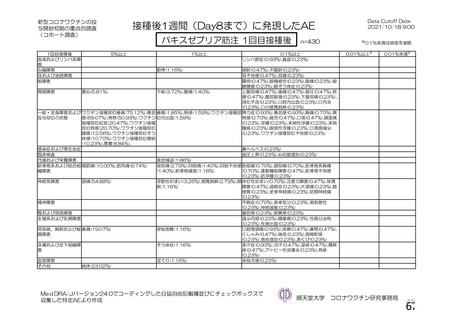
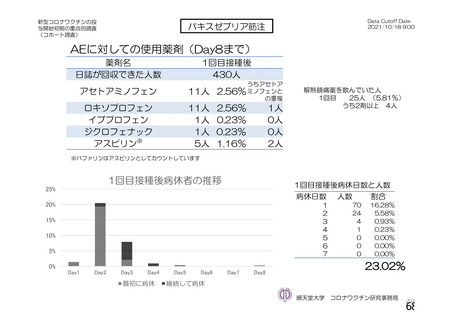
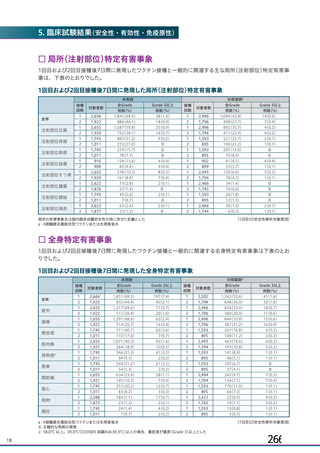
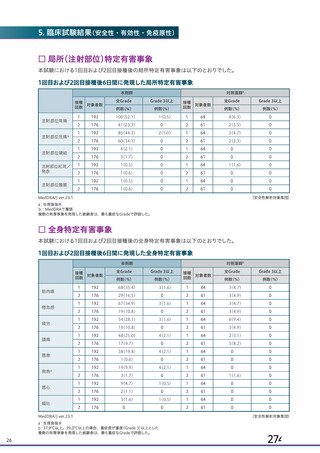
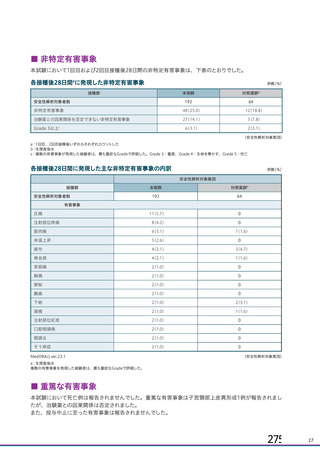
併合解析における国別の治験薬接種後 7 日以内に発現した特定有害事象及び治験薬接種後 28 日以内に発現した
非特定有害事象の要約(初回 SD 安全性解析対象集団 a)、DCO2)
初回接種後
2 回目接種後
英国(COV001、COV002)
特定有害事象評価対象例数
局所の特定有害事象 n(%)
グレード 3 以上 c)
全身の特定有害事象 n(%)
グレード 3 以上 c)
非特定有害事象 n(%)
グレード 3 以上 c)
ブラジル(COV003)
本剤群
対照群 b)
本剤群
対照群 b)
N=4122
N=3944
N=4122
N=3944
1645
1343(81.6)
13(0.8)
1312(79.8)
145(8.8)
923(22.4)
41(1.0)
1493
871(58.3)
4(0.3)
968(64.8)
18(1.2)
559(14.2)
26(0.7)
932
535(57.4)
0
515(55.3)
15(1.6)
403(9.8)
25(0.6)
825
375(45.5)
3(0.4)
387(46.9)
8(1.0)
436(11.1)
24(0.6)
N=5205
N=5209
N=5205
N=5209
82
46(56.1)
0
39(47.6)
0
915(17.6)
37(0.7)
70
13(18.6)
0
18(25.7)
0
605(11.6)
25(0.5)
N=990
N=988
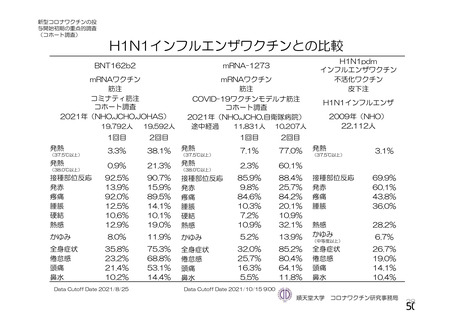
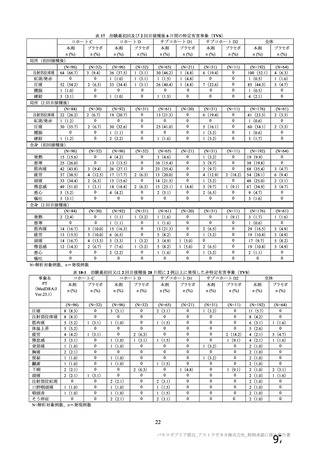
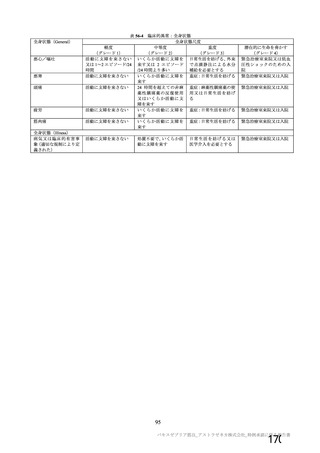
特定有害事象評価対象例数
局所の特定有害事象 n(%)
グレード 3 以上 c)
全身の特定有害事象 n(%)
グレード 3 以上 c)
非特定有害事象 n(%)
グレード 3 以上 c)
100
81(81.0)
1(1.0)
63(63.0)
8(8.0)
2857(54.9)
115(2.2)
南アフリカ共和国(COV005)
N=990
100
57(57.0)
1(1.0)
62(62.0)
1(1.0)
1978(38.0)
81(1.6)
N=988
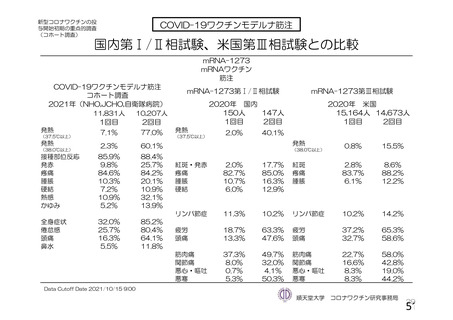
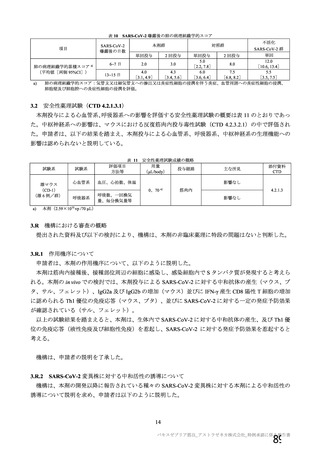
919
910
912
904
特定有害事象評価対象例数
局所の特定有害事象 n(%)
421(45.8)
166(18.2)
305(33.4)
110(12.2)
グレード 3 以上 c)
24(2.6)
9(1.0)
18(2.0)
4(0.4)
全身の特定有害事象 n(%)
476(51.8)
312(34.3)
301(33.0)
243(26.9)
グレード 3 以上 c)
44(4.8)
22(2.4)
25(2.7)
24(2.7)
非特定有害事象 n(%)
180(18.2)
164(16.6)
170(17.2)
160(16.2)
グレード 3 以上 c)
10(1.0)
9(0.9)
4(0.4)
11(1.1)
N=解析対象例数、n=発現例数
a) 特定有害事象については初回 SD 特定有害事象評価対象例を評価した。
b) COV001 試験及び COV002 試験では髄膜炎菌ワクチン 2 回接種群、COV003 試験では髄膜炎菌ワクチン+プラセボ
群、COV005 試験ではプラセボ 2 回接種群とされた。
c) グレード 3 以上の定義は 11.2 項表 56-1~3 参照
なお、本剤の人種別の有害事象発現状況について、特定有害事象の発現割合は、白人(94.8%)、アジ
ア人(97.2%)及び混血(92.3%)で同程度であったが、黒人(64.8%)では低かった。治験薬接種後 28
日間の非特定有害事象の発現割合は、全人種で同程度(白人 40.4%、アジア人 41.6%、黒人 40.2%及び混
血 57.6%)であった。人種間で認められた差は人口統計学的及び社会経済的差に起因するものであり、
人種間で安全性プロファイルに臨床的な差はないと考える。
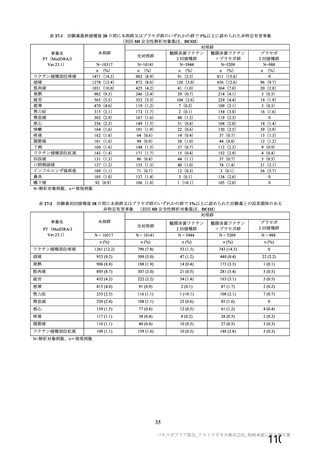
日本人(国内 D8111C00002 試験)と併合解析の安全性プロファイルについては、概ね同様であった
(7.R.3.1.1②項参照)。
以上より、本剤の安全性プロファイルについて、各国間で臨床的に意味のある差はないと考える。
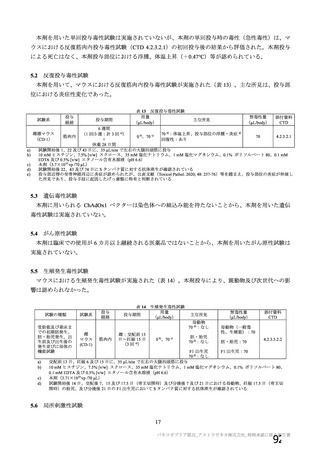
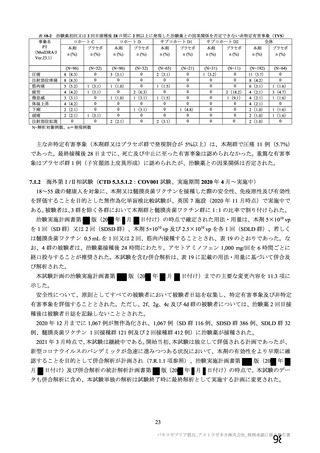
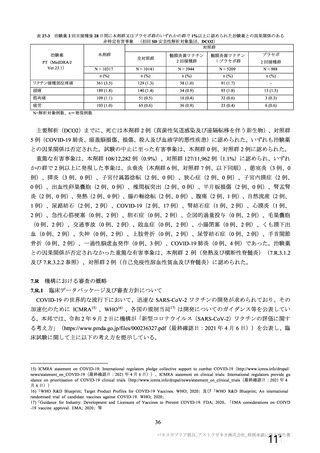
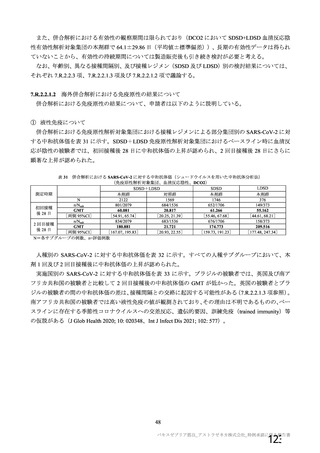
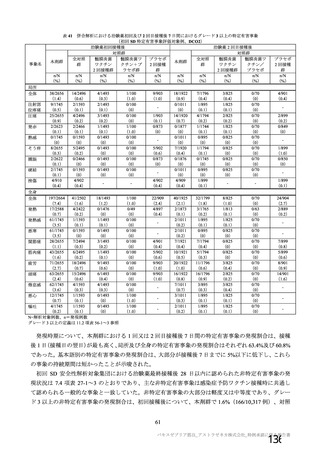
③ 接種間隔別
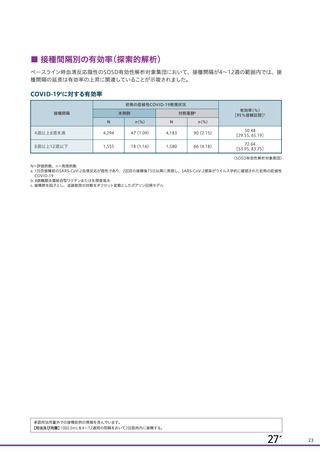
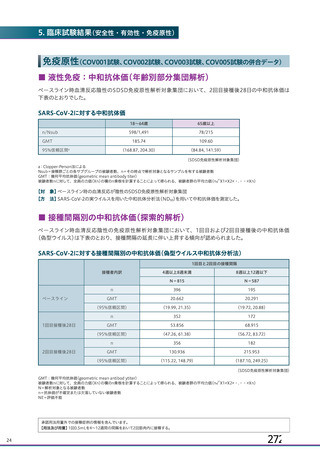
申請者は、接種間隔別の治験薬 2 回目接種後の有害事象の発現状況について、以下のように説明して
いる。
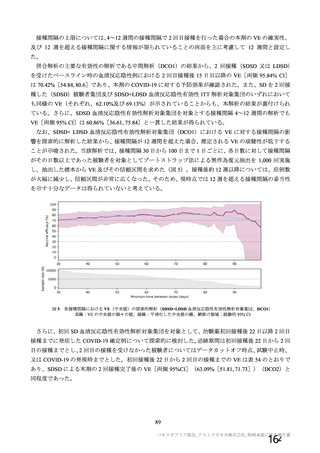
併合解析における接種間隔を 1 カ月毎に分けたときの特定有害事象発現割合は、接種間隔が 4 週未満
及び 4 週以上 8 週未満の被験者において、8 週以上 12 週未満及び 12 週以上の被験者と比較して低かっ
た(表 43)。接種間隔が短いほど特定有害事象の発現割合が減少する原因は不明であるが、集団特性の
65
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
140