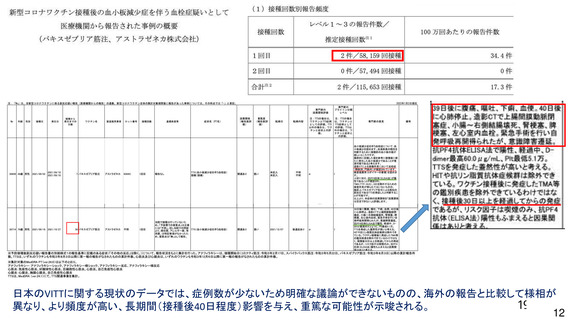
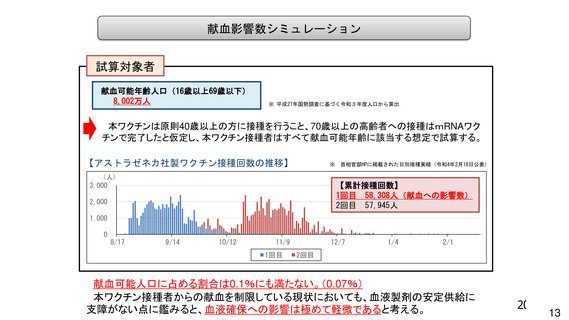
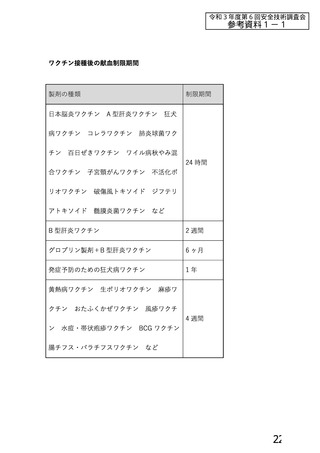
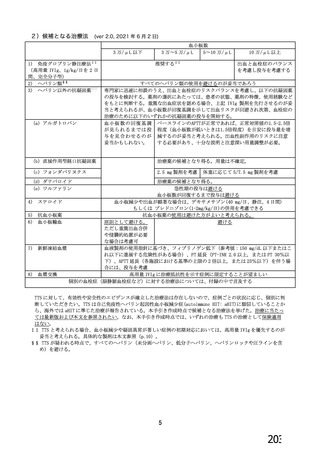
資 料4-1 令和3年度第6回安全技術調査会の審議結果について (185 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
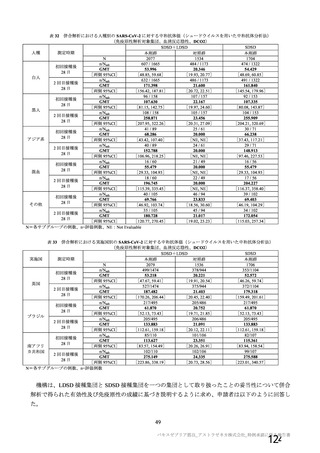
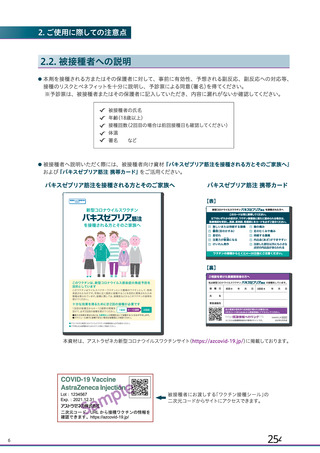
る。医療従事者向けウェブサイトには、最新の適正使用ガイド等の資材を掲載し、海外製造販売後にお
ける血小板減少症を伴う血栓症の発現状況、診断・治療のガイドライン、及び被接種者への適切な情報
提供について周知する。また、本邦での接種開始後に、血小板減少症を伴う血栓症の報告があった場合
には、最新の安全性情報として本ウェブサイトを通じて、情報提供することを予定している。診断・治
療のガイドラインについては、海外のガイドラインを参照するとともに、国内の外部専門家の助言を受
け、本邦において実用的なガイドラインとして提供する。
被接種者への情報周知については、被接種者向けウェブサイトを通じて行う計画である。本ウェブサ
イトには、最新の被接種者向け資材を掲載し、海外において本剤接種後に血小板減少症を伴う血栓症が
報告されていること、関連する症状の種類や発現時期等の情報、及び症状発現時には医療機関を救急受
診することを周知する。また、接種済証に貼付されるワクチン接種シールには、被接種者向けウェブサ
イトへのリンクの二次元コードを掲示するとともに、被接種者向け資材の印刷物を本剤納入時のバイア
ル数に応じて施設へ提供することを計画している。
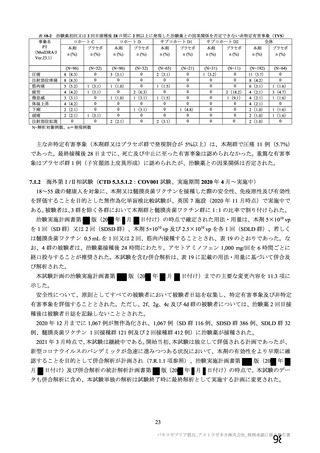
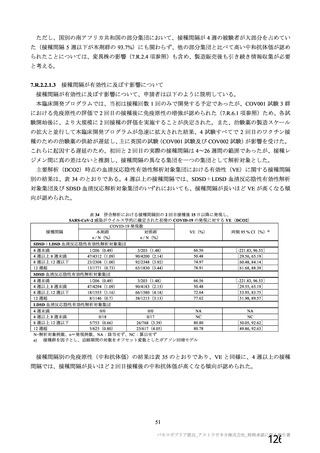
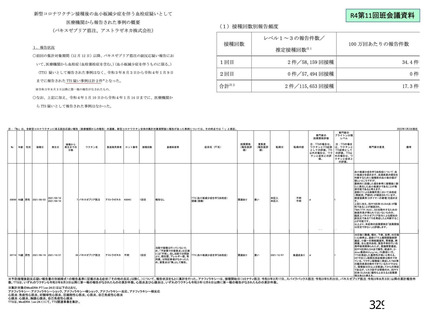
機構は、以上の議論を踏まえ、現時点における本剤の医薬品リスク管理計画(案)について、表 62 に
示す安全性検討事項を設定すること、並びに表 63~65 に示す追加の医薬品安全性監視活動及び追加の
リスク最小化活動を実施することが適切と判断した。
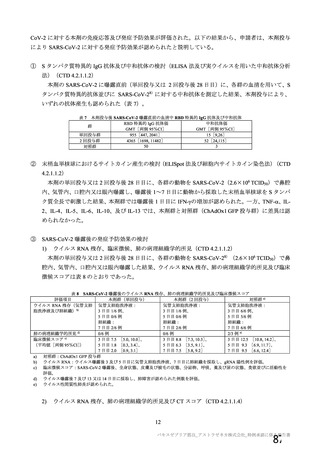
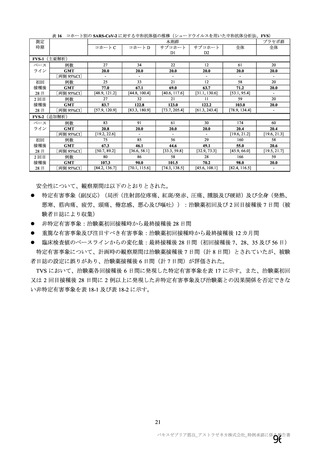
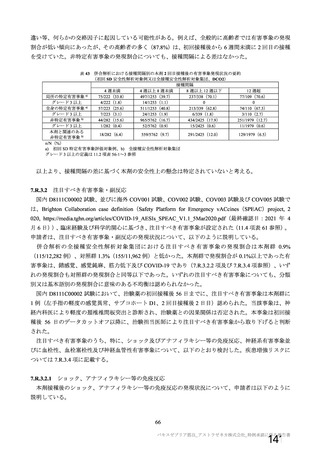
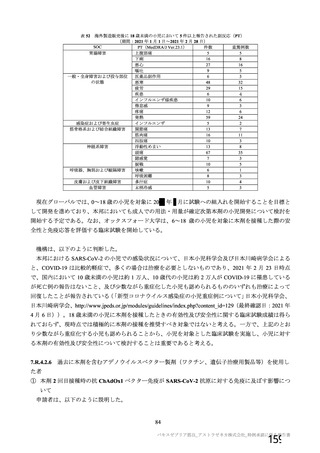
表 62 医薬品リスク管理計画(案)における安全性検討事項及び有効性に関する検討事項
安全性検討事項
重要な特定されたリスク a)
重要な潜在的リスク b)
重要な不足情報 c)
・ショック、アナフィラキシー ・免疫介在性の神経学的反応
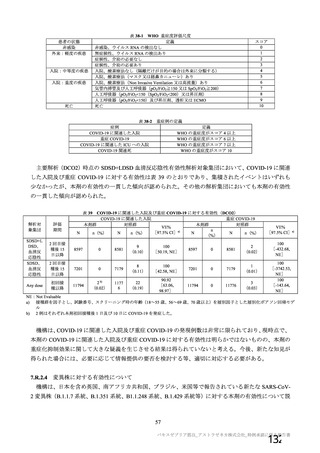
・COVID-19 の重症化リスクが高い
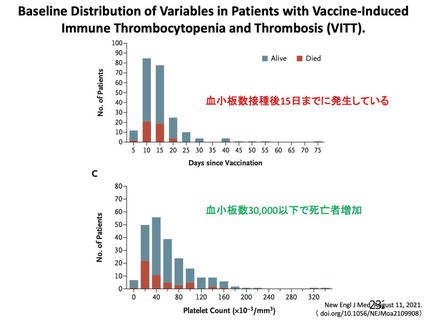
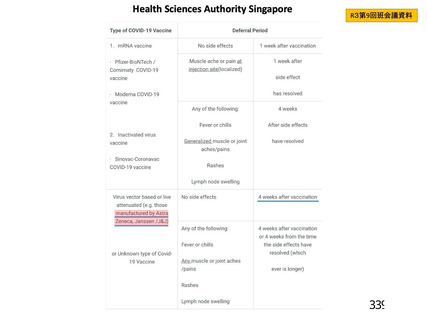
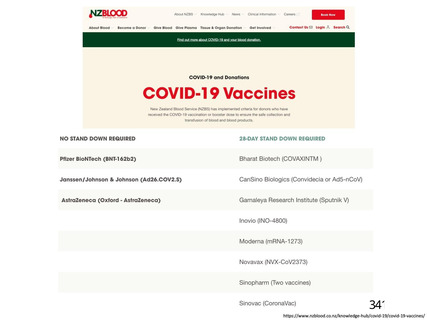
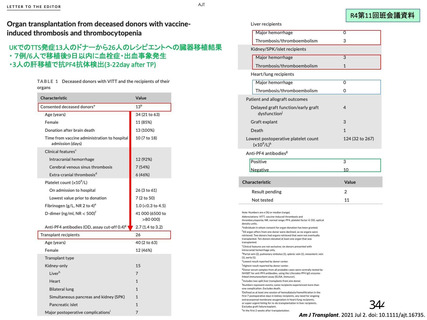
・血小板減少症を伴う血栓症
・ワクチン関連の呼吸器疾患増強(VAERD:
と考えられる基礎疾患を有する者
Vaccine-associated enhanced respiratory
における安全性
disease)を含むワクチン接種に伴う疾患 ・妊婦又は授乳婦に接種した際の安
増強(VAED: Vaccine-associated enhanced
全性
disease)
・血栓症
有効性に関する検討事項
該当なし
a) 医薬品との関連が十分な根拠に基づいて示されている有害事象のうち重要なもの。
b) 医薬品との関連性が疑われる要因はあるが、臨床データ等からの確認が十分でない有害な事象のうち重要なもの。
c) 医薬品リスク管理計画を策定した時点では十分な情報が得られておらず、製造販売後の当該医薬品の安全性を予
測する上で不足している情報のうち重要なもの。
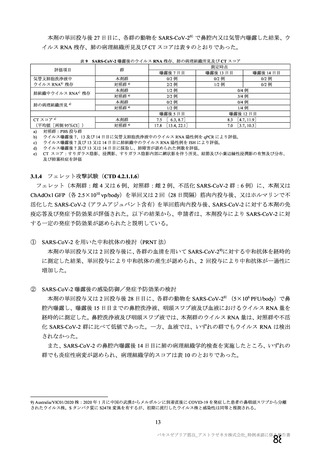
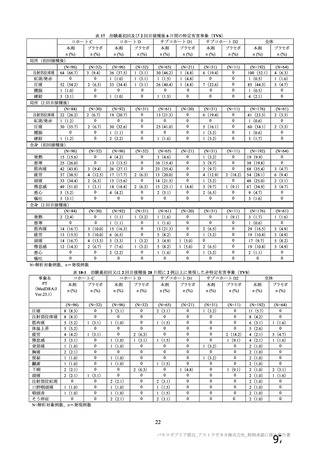
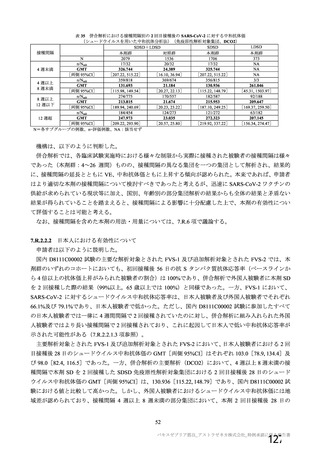
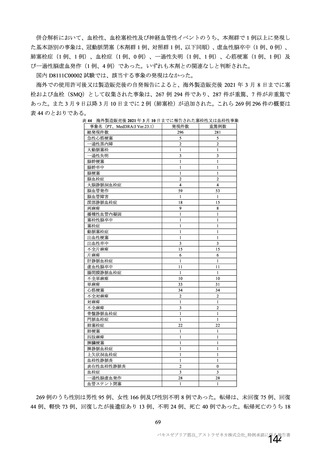
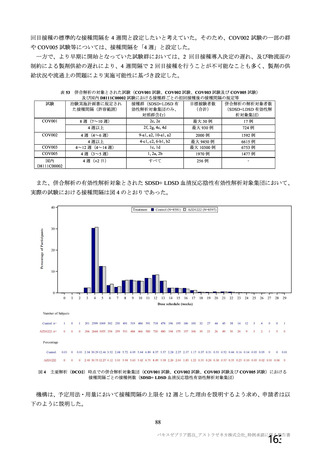
表 63
医薬品リスク管理計画(案)における追加の医薬品安全性監視活動及び追加のリスク最小化活動の概要
追加の医薬品安全性監視活動
追加のリスク最小化活動
・市販直後調査
・市販直後調査による情報提供
・一般使用成績調査(長期追跡調査)
・医療従事者向け資材(適正使用ガイド)の作成、提供
・特定使用成績調査(COVID-19 の重症化リスクが高いと考えら ・一般向け資材(バキスゼブリア筋注を接種される方とそ
れる基礎疾患を有する者)
のご家族へ)の作成、提供
・製造販売後臨床試験[国内 D8111C00002 試験]
・副反応発現状況の定期的な公表
・海外併合解析に含まれた COV001 試験、COV002 試験、
COV003 試験及び COV005 試験
・米国 D8110C00001 試験
108
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
183