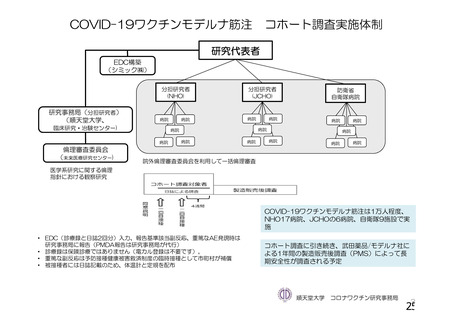
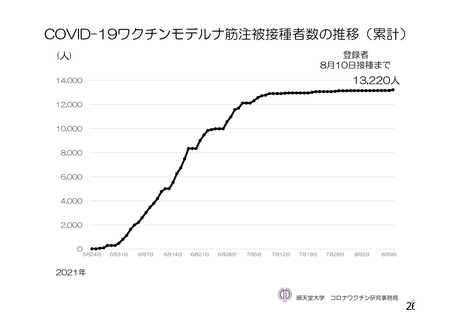
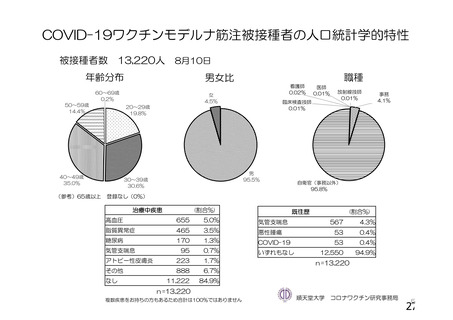
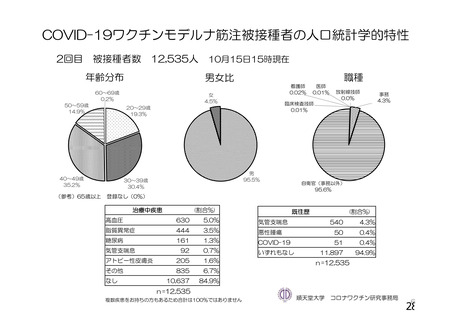
資 料4-1 令和3年度第6回安全技術調査会の審議結果について (158 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ただし、臨床試験では重度の疾患を有する被験者を除外したため、悪性腫瘍、慢性閉塞性肺疾患、慢性
腎疾患又は固形臓器移植による免疫不全状態を有する被験者等、重度の疾患を有する集団におけるベネ
フィット・リスクプロファイルは確認されていない。
また、本剤の臨床試験では除外された免疫不全状態の者では、一般にワクチンで予防可能な疾患の罹
患率、及びその疾患による死亡のリスクが高い。一方、重度の免疫不全を有する者においては、免疫系
が十分な反応を示さず、ワクチンの効果は減弱すると考えられる。免疫抑制薬の投与を受けた者を含め、
免疫応答に障害を有する者において、免疫系に異常のない者と同じ免疫反応が本剤接種により誘発され
るか否かは未知であり、本剤の安全性について得られているデータは限られているものの、現在のとこ
ろ本剤の安全性プロファイルが一般集団と異なるというエビデンスは得られていない。
これらの者に本剤を接種した際の安全性については、製造販売後にも引き続き調査、情報収集を行う。
なお、COV002 試験及び COV005 試験では、医学的に安定している HIV 陽性者を対象とし、免疫原性及
び安全性を検討しており、この結果は得られ次第提出する予定である。
機構は、以下のように判断した。
本邦において優先接種の対象とされる基礎疾患等を有する者に本剤を接種したときの有効性及び安全
性について、今回申請された臨床データパッケージに含まれる臨床試験成績から得られるデータは限ら
れている(7.R.2.2.1.1 項及び 7.R.3.3.1 項参照)。一方で、これらの基礎疾患等は COVID-19 重症化のリ
スク因子とされ(新型コロナウイルス感染症 COVID-19 診療の手引き(第 4.2 版))、これらの基礎疾
患等を有する者では COVID-19 の予防が重要であることから、本剤の必要性は高いと考えられる。個々
の患者の状況又は状態を踏まえ、接種するベネフィットが本剤のリスクを上回ると判断された場合に本
剤は接種されるものと想定される。したがって、製造販売後の調査又は観察研究、現在実施中の臨床試
験における HIV 陽性者における情報等から、基礎疾患等を有する人に対する本剤接種について新たな知
見が得られた場合には、速やかに情報提供する必要がある。
7.R.4.2.2
高齢者
申請者は、高齢者に対する本剤接種について、以下のように説明している。
2021 年 3 月 27 日時点で、本剤は 70 カ国以上で承認されており、すべての国で 65 歳以上の高齢者を
含む 18 歳以上の者における COVID-19 の予防を適応として承認されている。また、WHO からも 65 歳
以上の高齢者を含めた 18 歳以上の成人における COVID-19 の予防のための能動免疫獲得を目的とした
緊急使用許可を受けている。なお、米国では、65 歳以上の高齢者を含む大規模(30,000 例以上)の臨床
試験が実施中であり、被験者の 23 %以上が 65 歳以上である。
7.R.2.2.3 項及び 7.R.3.3.2 項で検討したとおり、併合解析及び国内 D8111C00002 試験の有効性及び安
全性データ及び海外製造販売後の安全性情報から、本剤は高齢者においても有効性が期待でき、安全性
についても忍容可能である。高齢者は COVID-19 の重症化リスクが特に高い集団であり、現在の COVID19 の緊急事態において、本剤は高齢者の COVID-19 罹患リスクを低減するという公衆衛生上の目的を十
分に果たすものと考える。
機構は、以下のように判断した。
81
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
156