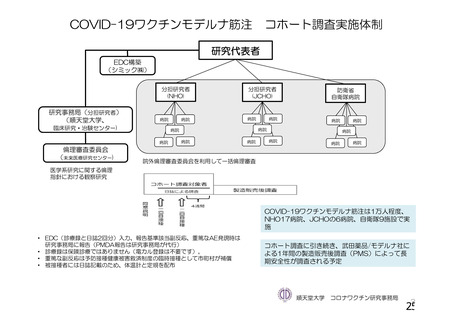
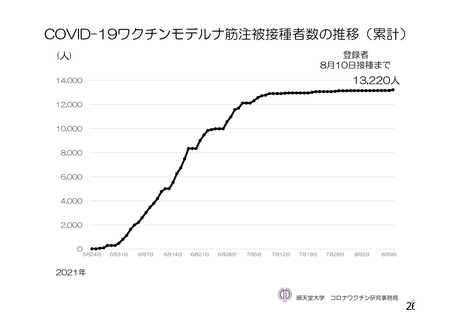
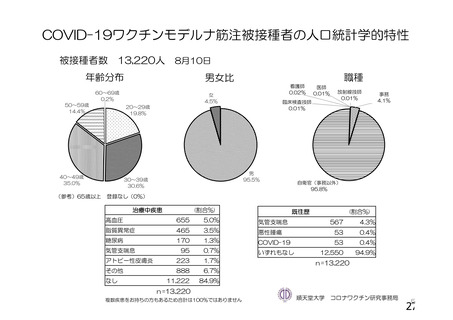
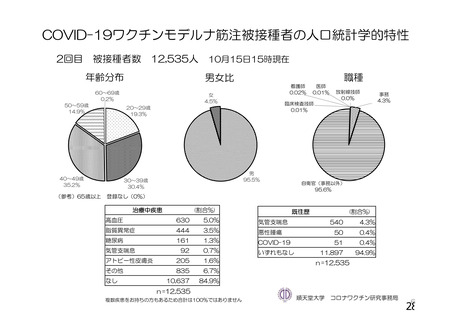
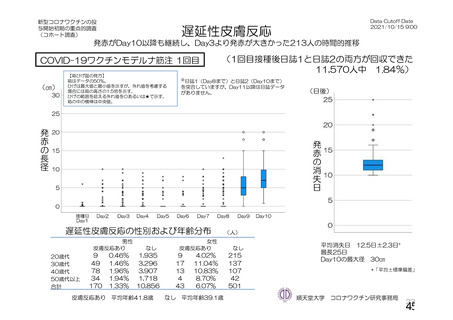
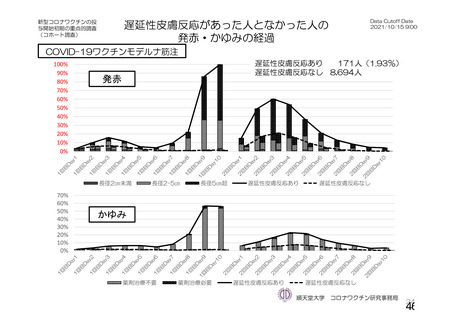
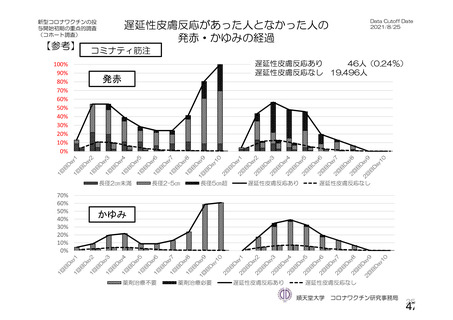
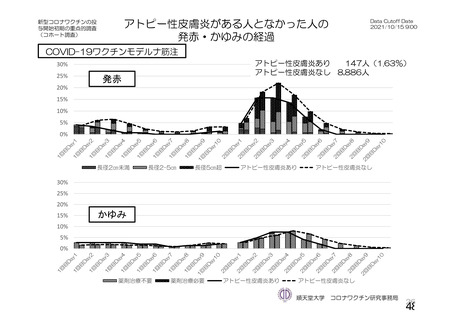
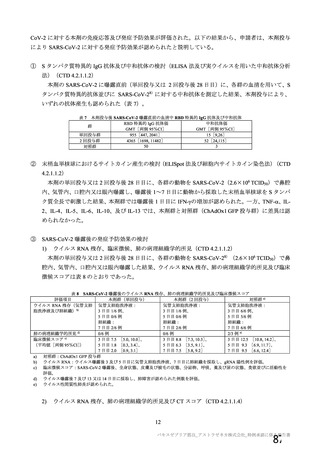
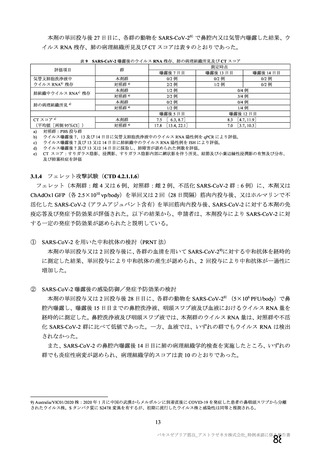
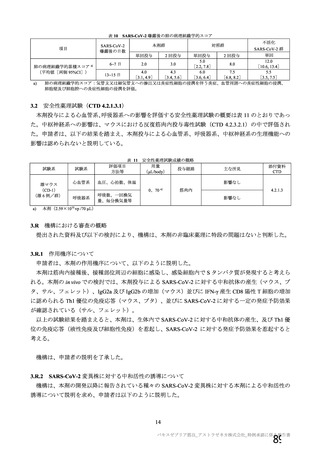
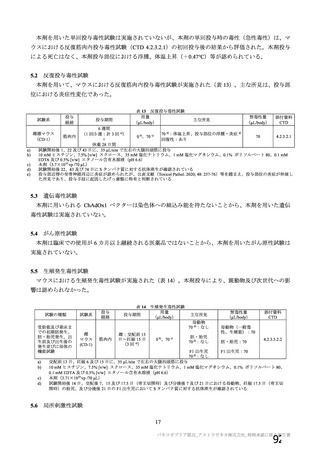
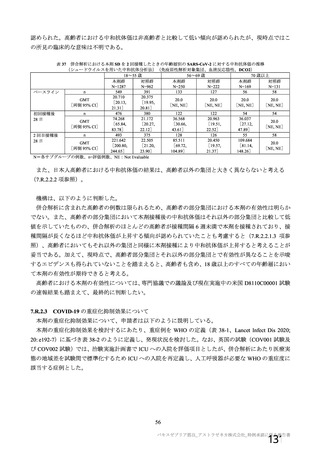
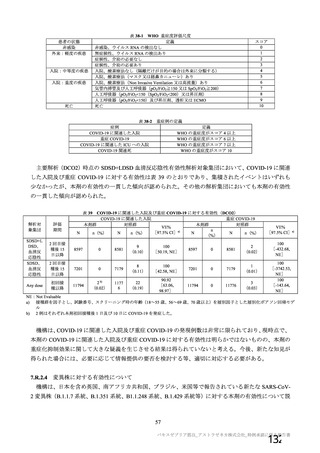
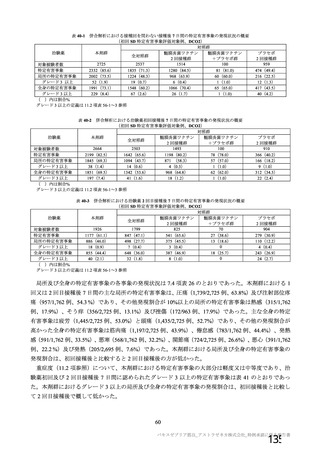
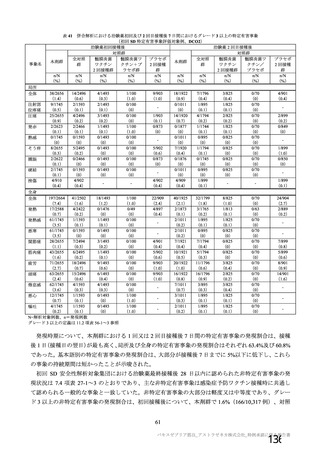
資 料4-1 令和3年度第6回安全技術調査会の審議結果について (175 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
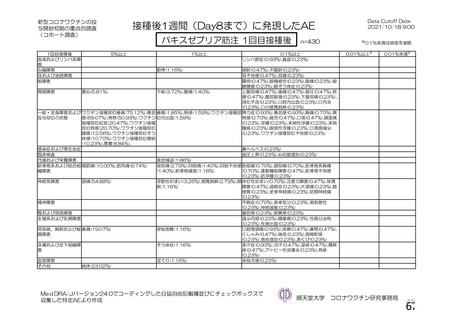
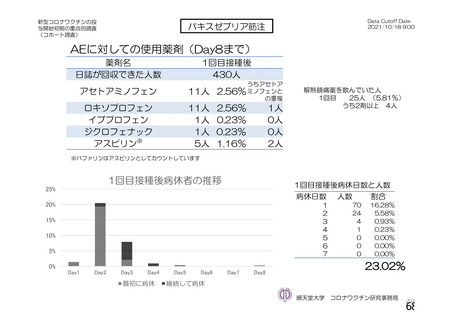
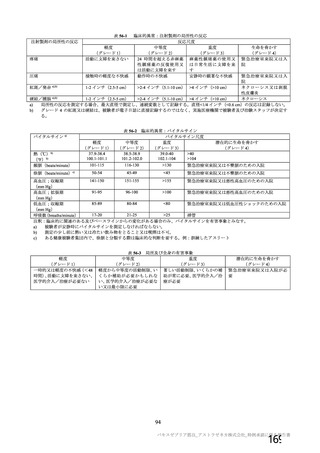
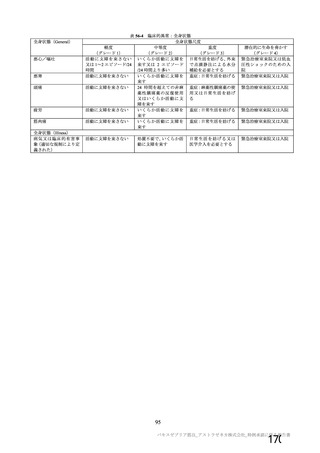
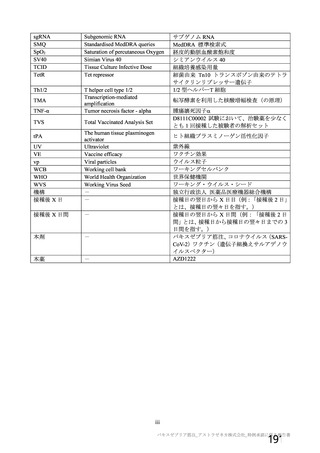
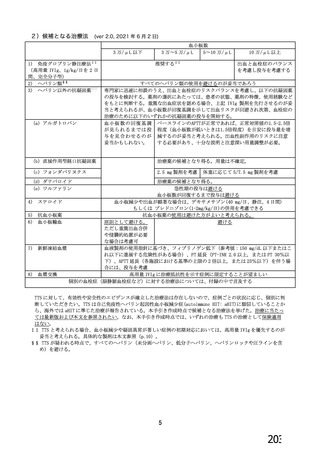
用法・用量
症例数
選択基準
除外基準
COV003 試験の治験実施計画書第
変更内容
(治験実施計画書版番号)
1c 及び 1d 群の 2 回目接種群を追加(
日)
版(20
年
版、20
年
月
妊娠の転帰が中絶又は流産である場合、2 回目の接種を受
けることができることを明確化(
版、20 年 月
日)
①組入れ前の COVID-19 血清反応陰性の規定を削除(
版、20 年 月
日)
②COVID-19 の既往歴は、血清学的検査又は PCR での確
認可能であることを明確化。(
版、20 年 月
日)
③2 回目接種に関する除外基準を追加し、初回接種後の被
験者の安全性又は試験結果の解釈に影響を及ぼす可能性が
ある有害事象、4 週間以内(症状がある場合)又は 2 週間
以内(無症状の場合)に SARS-CoV-2 の PCR 検査陽性を
除外対象に加えた。(
版、20 年 月
日)
④COVID-19 の既往歴の確認は、抗原や抗体に基づく迅速
検査でも可能であることを明確化(
版、20 年 月
日)
COV005 試験の治験実施計画書第
変更内容
(治験実施計画書版番号)
日付け)までの主要な改訂内容
変更理由
①2000 例(ワクチンの供給状況に応じて最大 5000 例)か
ら最大 10000 例まで増加(
版、20 年 月 日)
②最大 10300 例まで増加(
版、20 年
月
日)
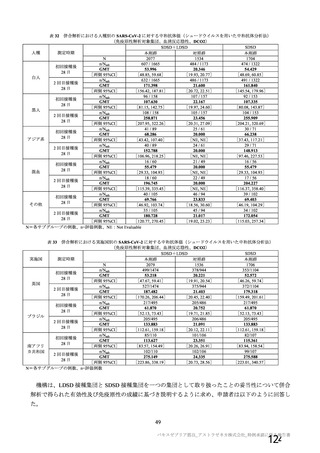
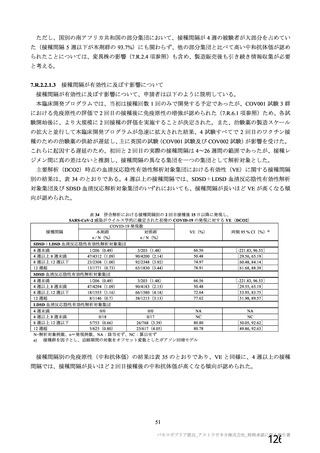
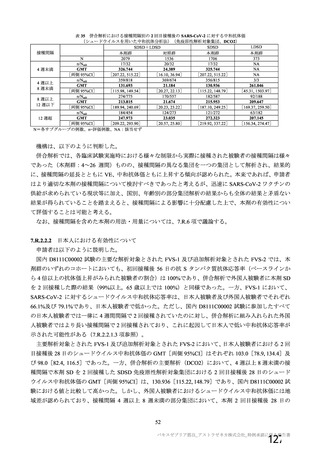
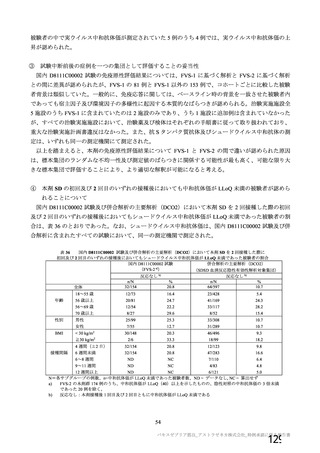
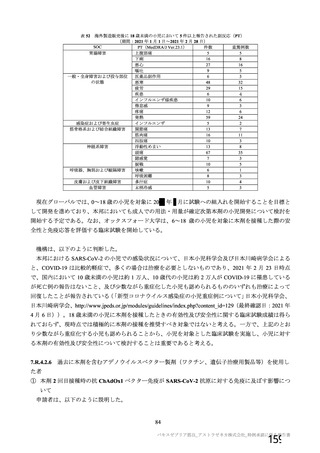
表 60
月
版(20
年
COV001 試験 3 群の免疫原性の中間結果から、1 回
接種と比較して 2 回接種で中和抗体価が改善するこ
とが示されたため。
①高齢者コホート及び施設の追加、及び 2 回接種を
含めるための変更。
②複数の施設における競合的かつ同時に被験者組入
れを行うため。
組入れ基準を明確にするため。
①FDA ガイドラインでは、感染歴のある者でのベネ
フィット・リスクを評価することの重要性から既感
染例を除外しないことを推奨している。また、検査
機関の流通上の制約から血清学的検査の結果が予定
どおり提供できないため。
②組入れ基準を明確にするため。
③被験者の安全性及び治験結果の解釈可能性を確保
するため。
④組入れ基準を明確にするため。
月
日付け)までの主要な改訂内容
変更理由
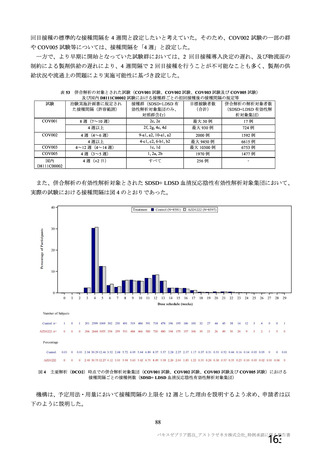
用法・用量
①接種間隔を 28±3 日から 28±7 日に変更(
版、
20 年 月
日)
②2 回接種スケジュールに変更(
版、20 年
月
日)
③被験者が 2 回目接種前に COVID-19 又は無症候性
の SARS-CoV-2 感染を発症した場合の 2 回目接種の
時期について明確化(
版、20 年 月
日)
症例数
①2 群の被験者数を 550 例から 2150 例増加し 2700
例(合計 2800 例)とした。(
版、20 年 月
日)
②合計被験者数を 2800 例から 2000 例に減少(2a
群:550 例から 250 例に変更、2b 群:2150 例から
1,650 例に変更)(
版、20 年 月
日)
③1 群の被験者数を 50 例から 70 例に増加、これに
より全体の被験者数を 2000 例から 2020 例に増加
(
版、20 年 月
日)
④3 群の被験者数を 50 例から 100 例に増加。これに
より全体の被験者数は 2070 例に増加(
版、20
年 月
日)
選択基準
被験者の年齢上限を 55 歳から 65 歳以下に引き上げ
(
版、20 年 月 日)
除外基準
①COVID-19 の既往歴又は現病のある者を除外基準
に追加(
版、20 年 月
日)
②過去に感染があった被験者を除外するためのスク
リーニング来院時の COVID-19 の血清学的検査を削
除(
版、20 年 月
日)
主要評価項目
主要有効性評価項目を「2 回目の接種後 15 日以降に
発現した COVID-19」と定義(
版、20 年 月
日)
①英国の COV001 試験の計画に合わせるため。
②COV001~COV005 試験を担当するデータ安全性モニタリ
ング委員会は、COV001 試験における安全性及び免疫原性の
評価結果を受けて、本試験で 2 回接種を実施することを勧告
した。
③臨床的に安定しており、COVID-19 からの十分な回復が示
された場合にのみ 2 回目接種が行われることを担保するた
め。
①SARS-CoV-2 感染の勢いが予測不可能であること及び
COV001 試験における COVID-19 発症率が予想より低かった
ことを受け被験者数を増加。
②プラセボ群の発症率を 2.5%にから 3.5%として被験者数を
再算出した。
③安全性コホートにおいて適切な評価可能例数を確保するた
め。最初の 24 例のうち 6 例が組入れ時の鼻スワブで SARSCoV-2 陽性と判定され、評価可能でない被験者の割合が想定
より高かった。
④約 1/3 が SARS-CoV-2 に対する血清反応陽性例と判定され
ると予想されるため、被験者数を 100 例とすることで、約
30 例の血清反応陰性例が確保できる。
以下の臨床倫理委員会の勧告に沿った:併発疾患の有病率は
年齢の増加に伴い増加するが、55 歳以上のすべての成人が
脆弱なわけではなく、選択基準を満たし、除外基準に抵触し
ない場合、本治験に参加する機会を与えるべきである。
①集団が不均一となり免疫原性評価に対する影響を避けるた
めに現在又は過去の感染例を除外する。
②FDA ガイドラインでは、過去の感染に関するスクリーニ
ングを実施しないことが提案されている。また、感染歴のあ
る集団でのベネフィット・リスクを評価する必要性がある。
さらに、検査機関における流通上の問題により、血清学検査
結果を適時提供することが難しかった。
免疫原性の改善(COV001 試験データ)に基づく 2 回接種ス
ケジュールの採用決定に伴い変更。
98
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
173