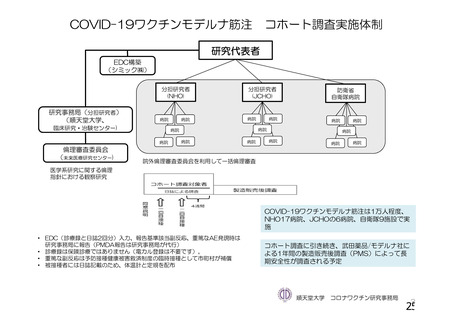
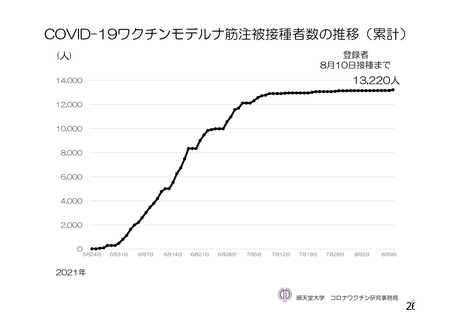
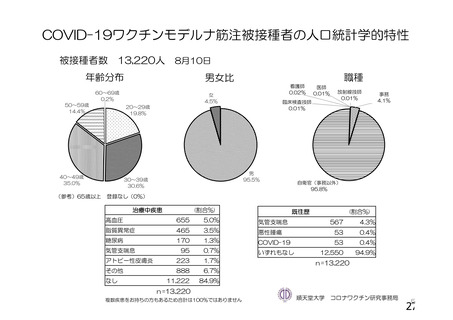
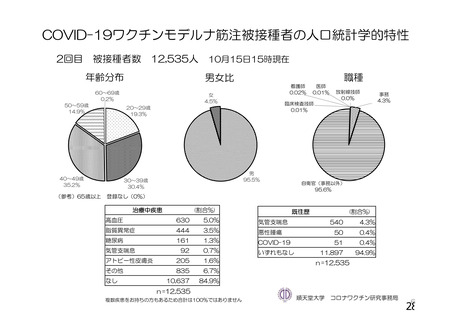
資 料4-1 令和3年度第6回安全技術調査会の審議結果について (110 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
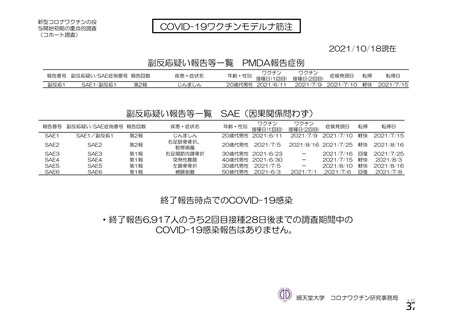
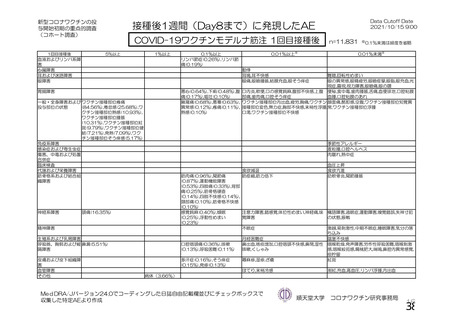
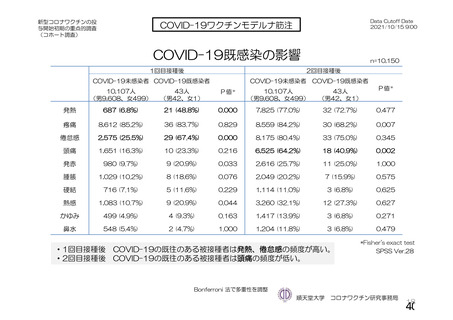
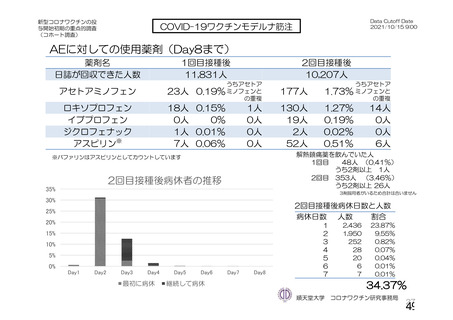
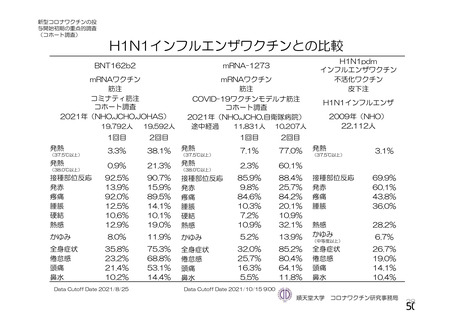
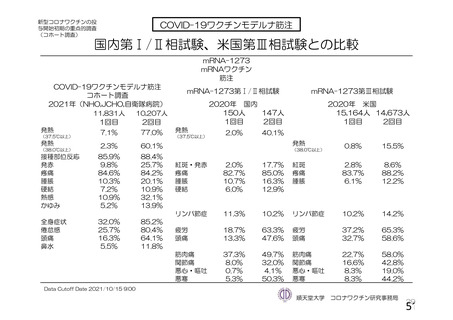
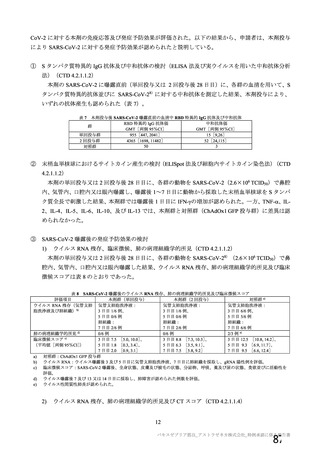
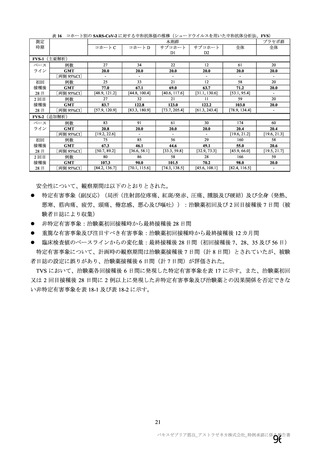
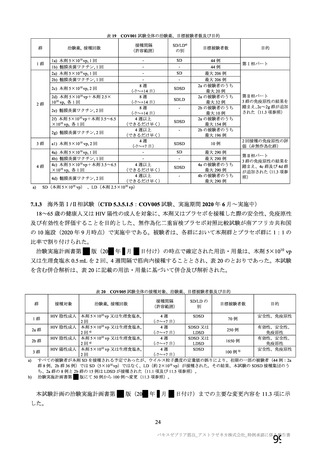
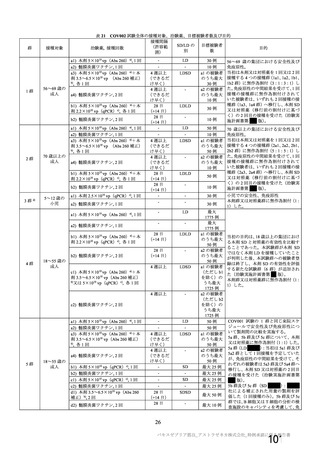
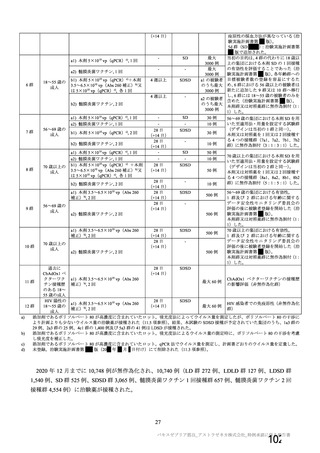
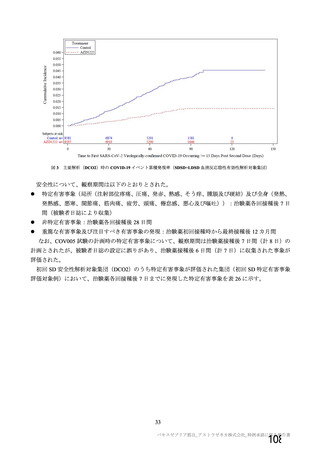
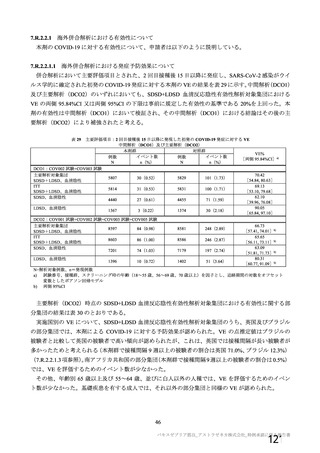
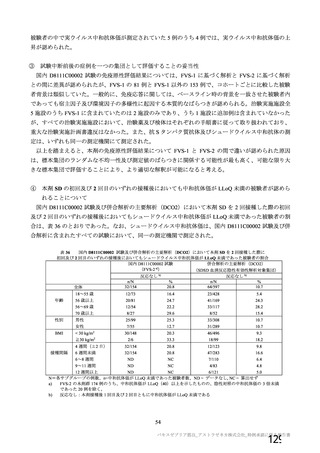
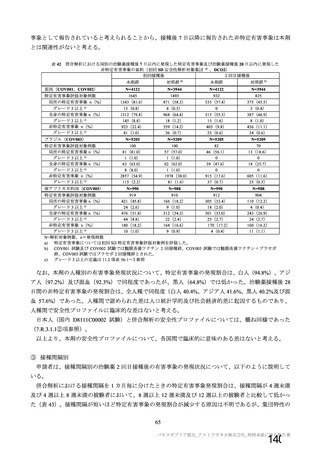
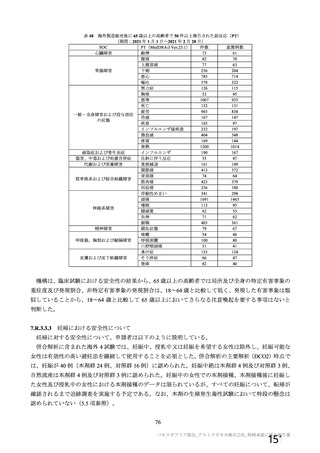
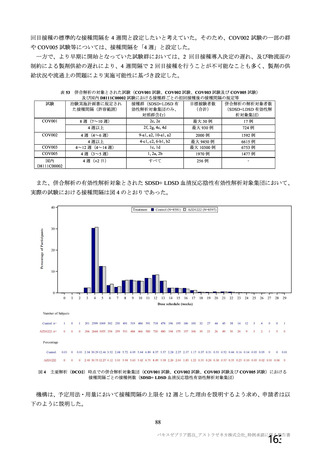
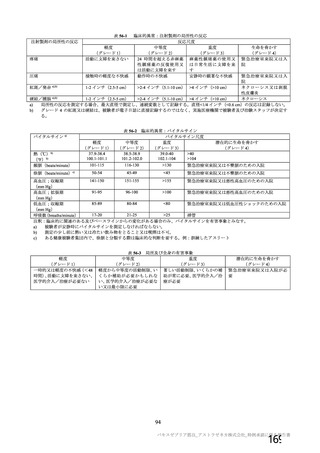
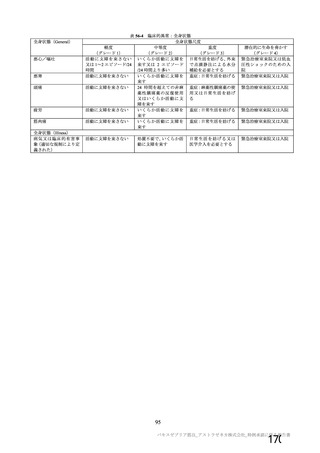
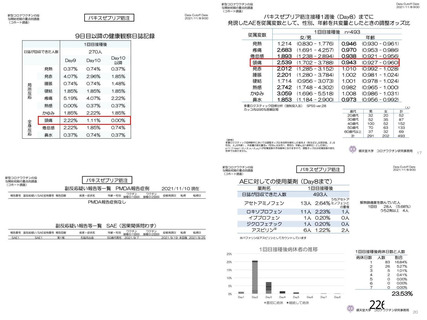
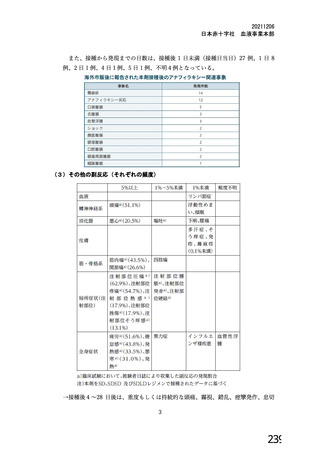
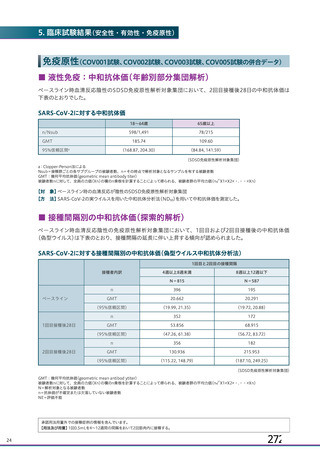
主要解析(DCO2)時の COVID-19 イベント累積発現率(SDSD+LDSD 血清反応陰性有効性解析対象集団)
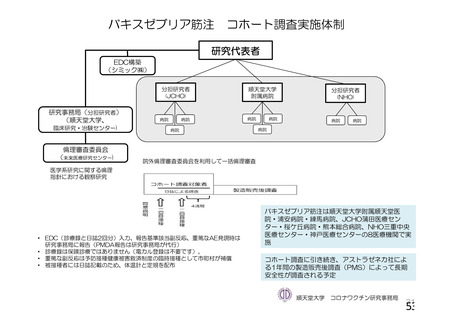
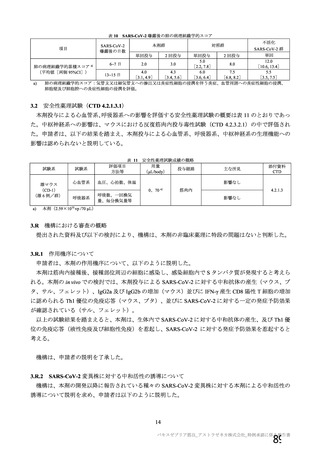
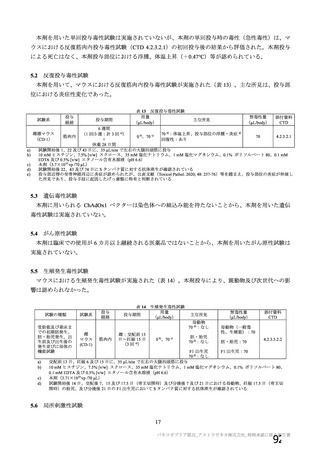
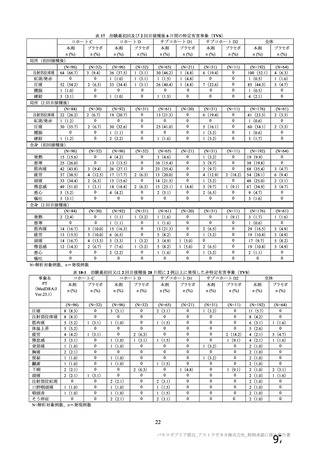
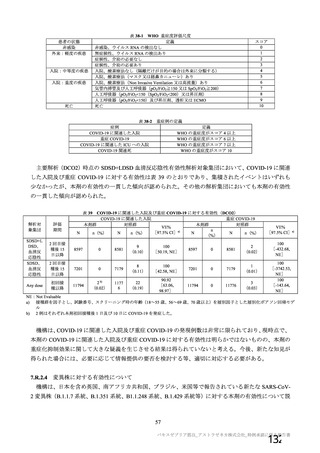
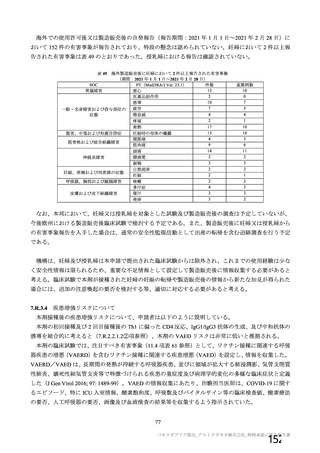
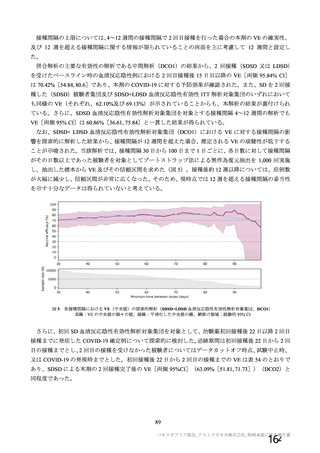
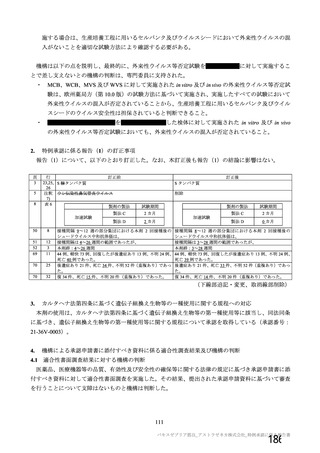
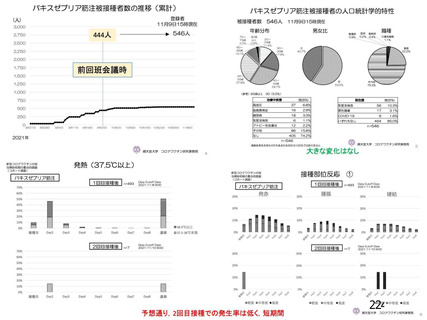
安全性について、観察期間は以下のとおりとされた。
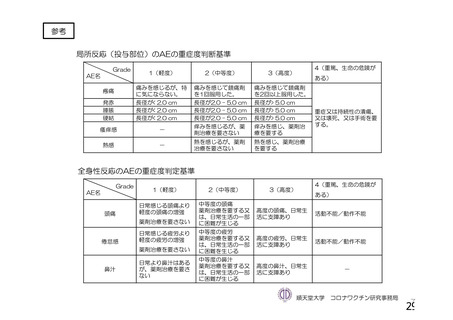
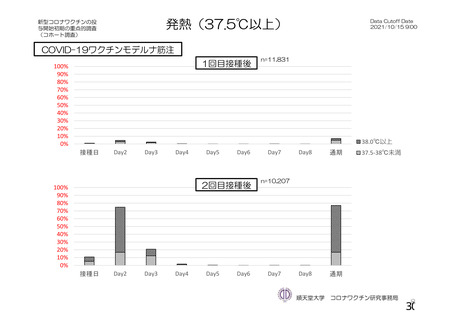
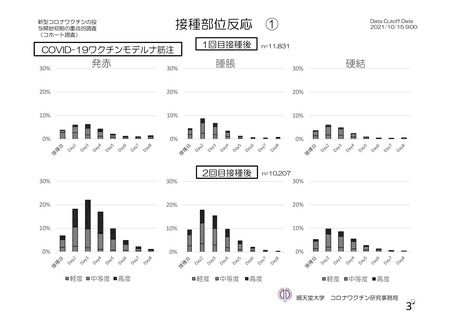
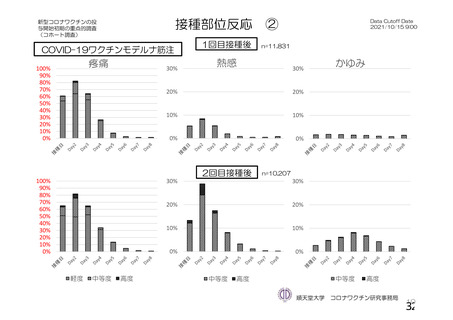
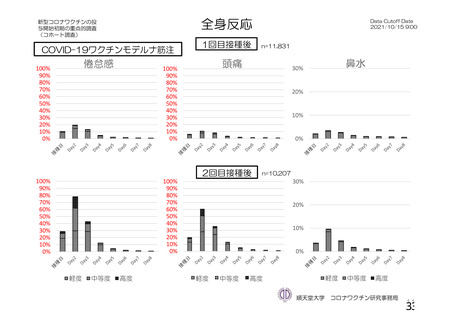
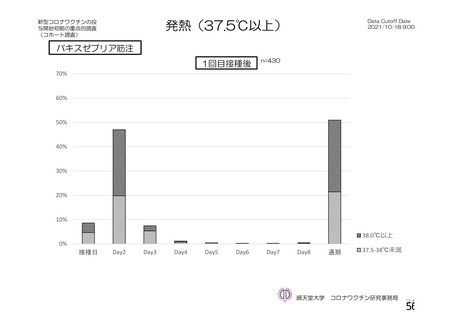
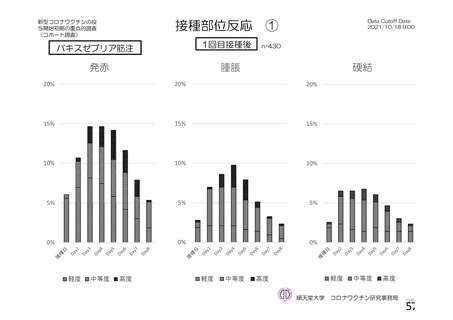
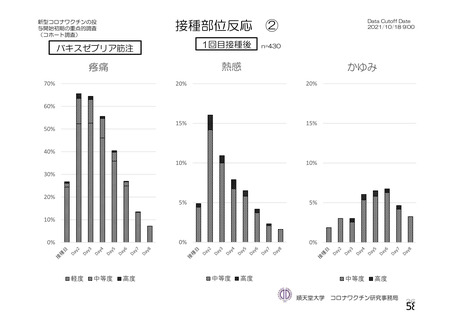
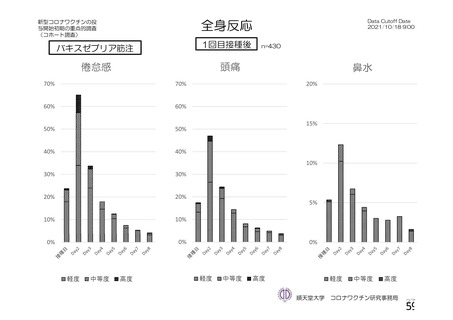
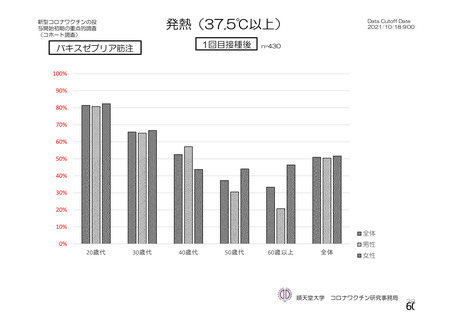
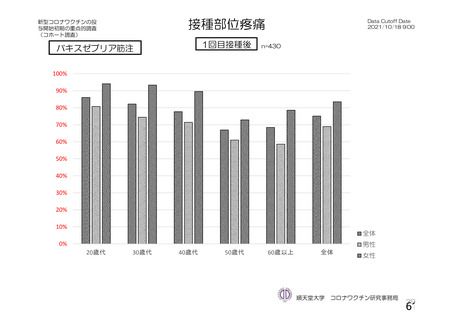
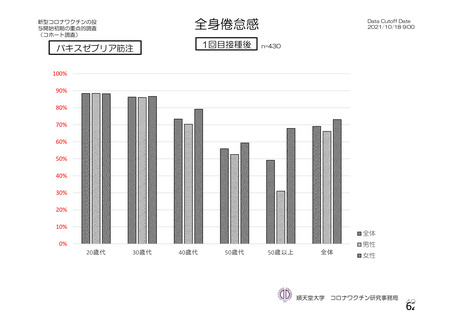
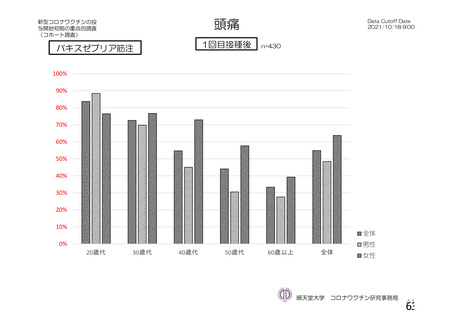
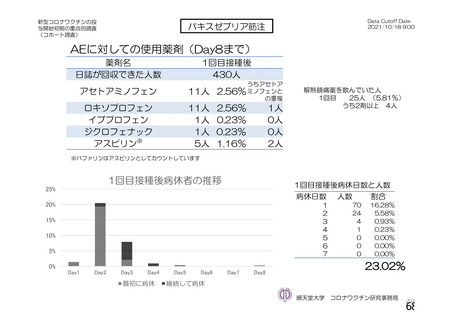
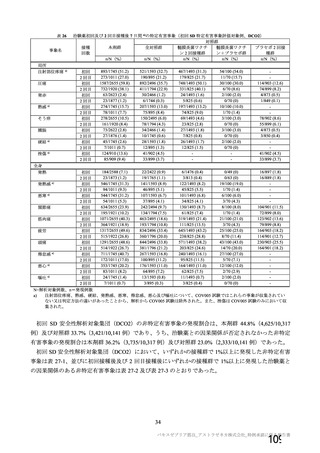
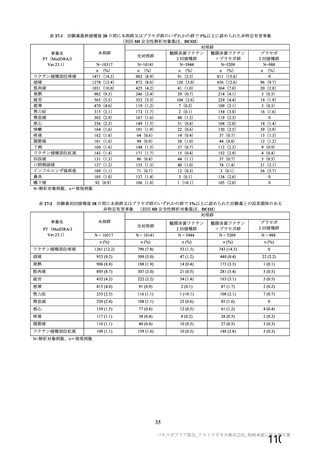
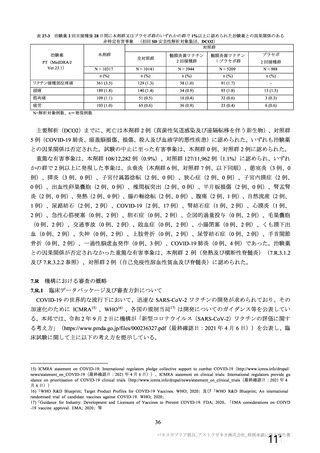
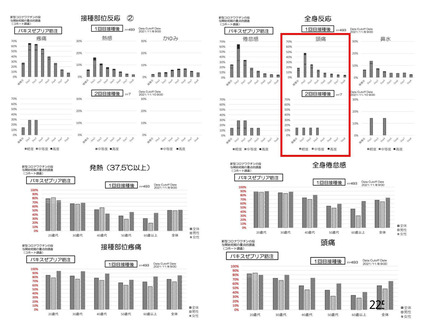
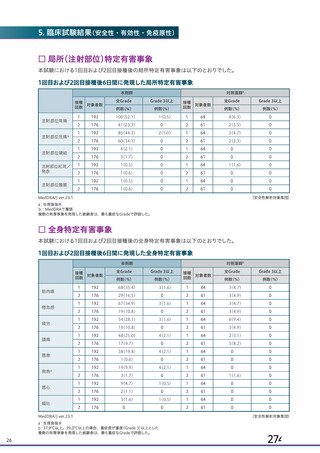
特定有害事象(局所(注射部位疼痛、圧痛、発赤、熱感、そう痒、腫脹及び硬結)及び全身(発熱、
発熱感、悪寒、関節痛、筋肉痛、疲労、頭痛、倦怠感、悪心及び嘔吐)):治験薬各回接種後 7 日
間(被験者日誌により収集)
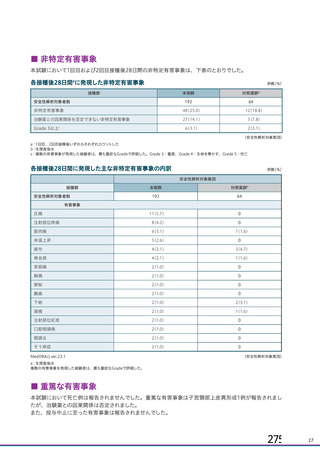
非特定有害事象:治験薬各回接種後 28 日間
重篤な有害事象及び注目すべき有害事象の発現:治験薬初回接種時から最終接種後 12 カ月間
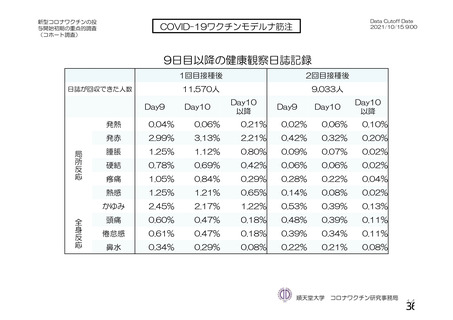
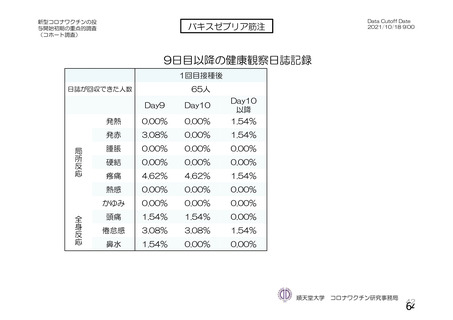
なお、COV005 試験の計画時の特定有害事象について、観察期間は治験薬接種後 7 日間(計 8 日)の
計画とされたが、被験者日誌の設定に誤りがあり、治験薬接種後 6 日間(計 7 日)に収集された事象が
評価された。
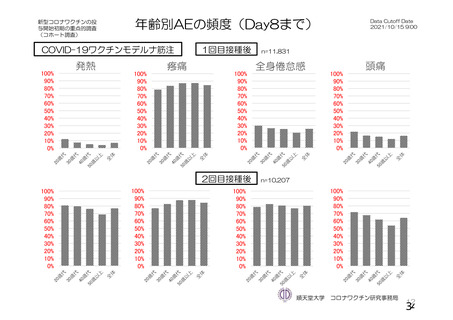
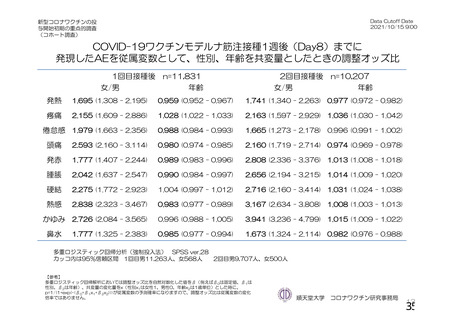
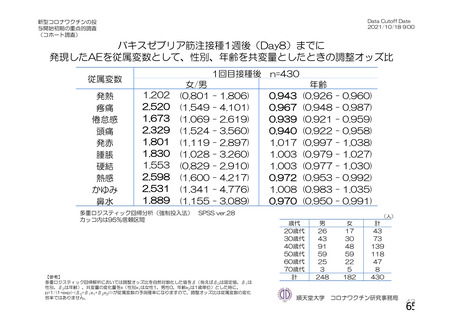
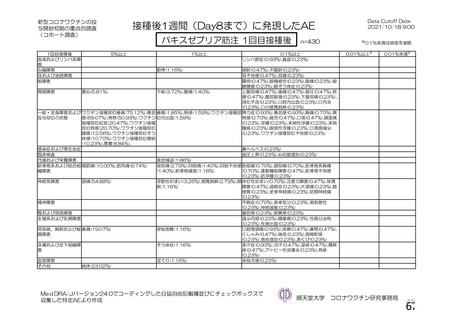
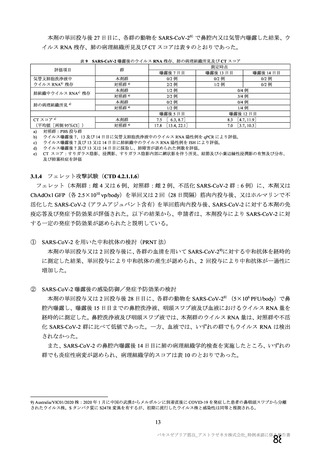
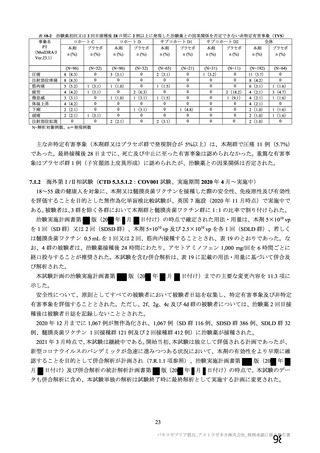
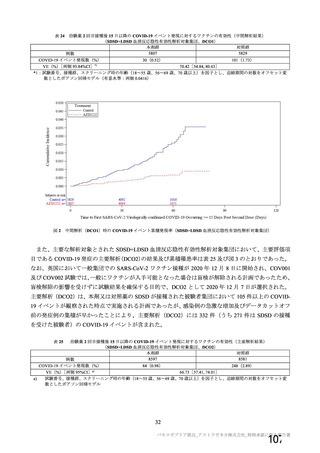
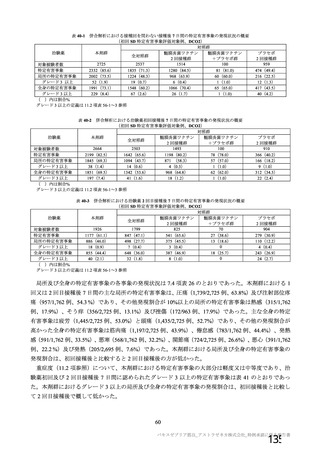
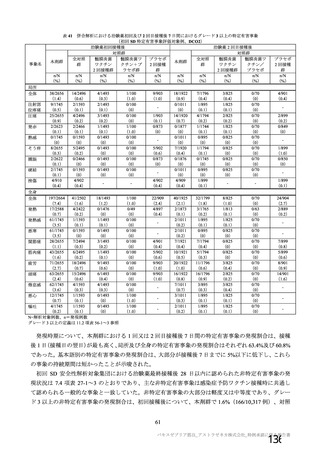
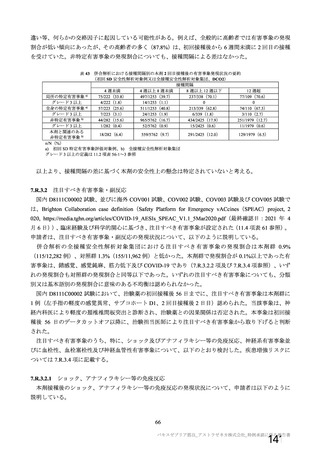
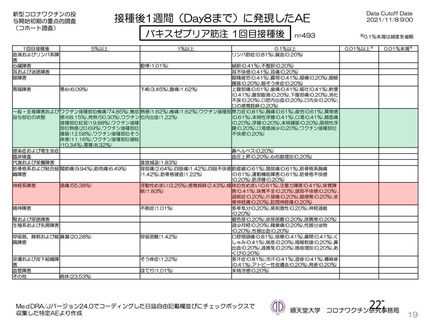
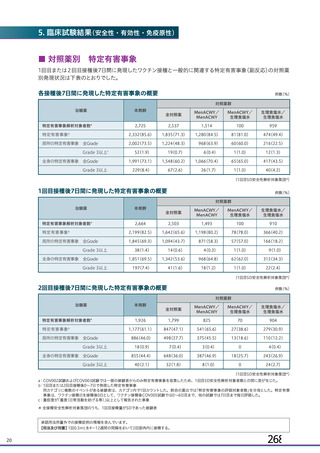
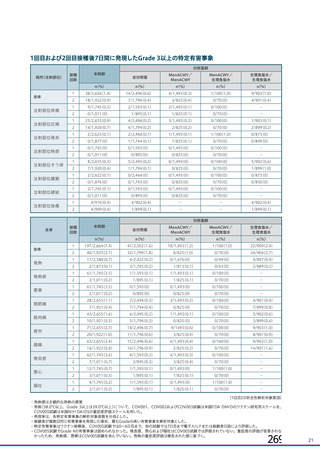
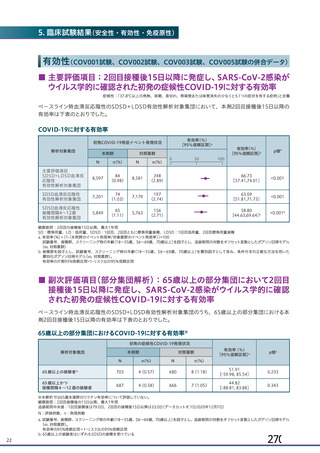
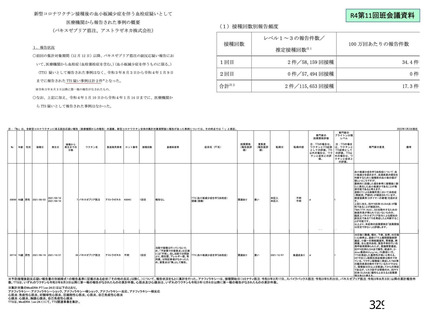
初回 SD 安全性解析対象集団(DCO2)のうち特定有害事象が評価された集団(初回 SD 特定有害事象
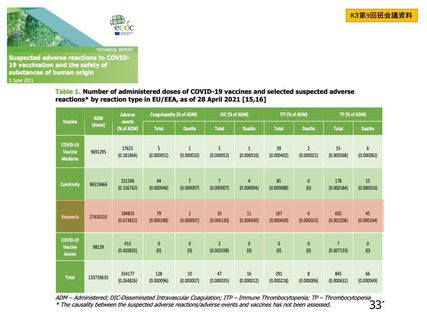
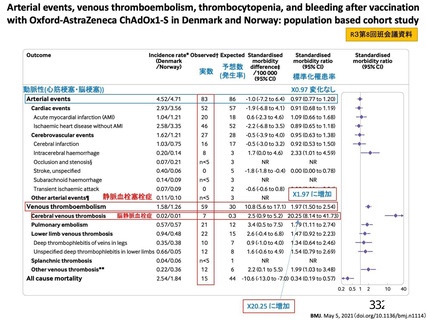
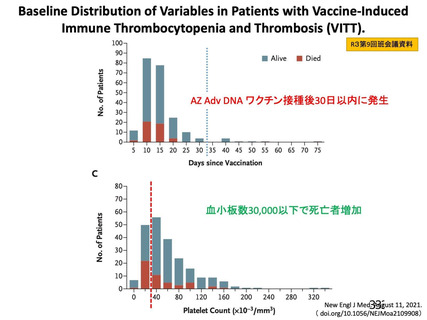
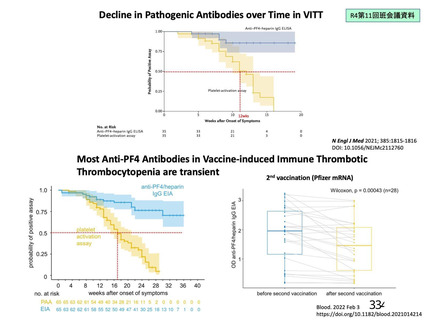
評価対象例)において、治験薬各回接種後 7 日までに発現した特定有害事象を表 26 に示す。
33
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
108
関連画像
ページ内で利用されている画像ファイルです。