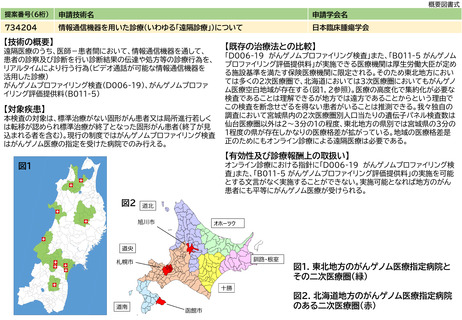
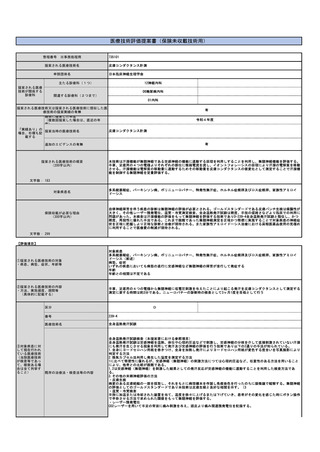
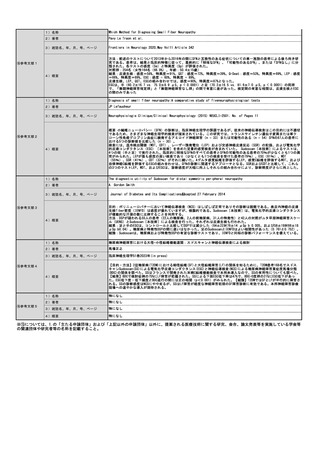
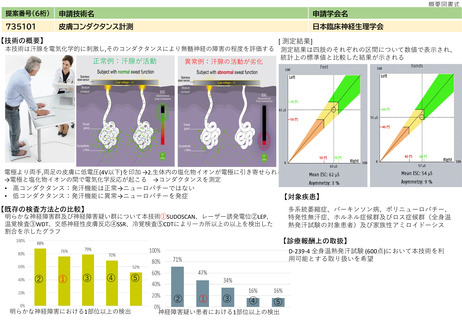
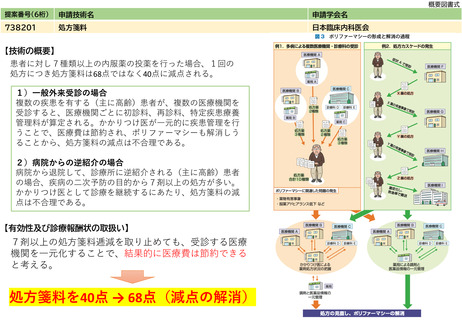
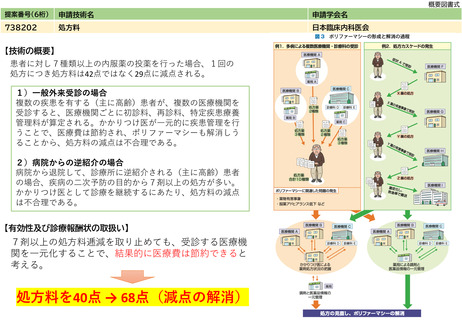
提案書21(4001頁~4203頁) (64 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
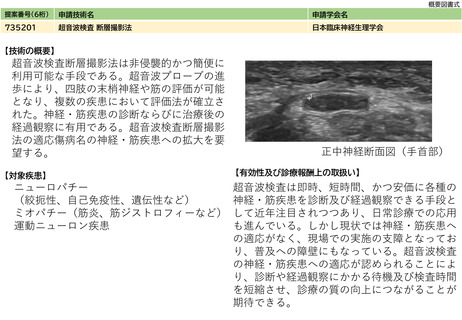
ラスツズマブの配合皮下注製剤はそれぞれの点滴静注製剤による併用療法における安全性プロファイルと概ね一致している。これらに加えて、患
治癒率、死亡率やQOLの改善等の長期予 者の身体的負担の軽減、治療拘束時間の短縮化等によりQOLの向上が期待されている。
後等のアウトカム
一方、これらの皮下投与では、投与者は介添えで一定時間以上をかけて緩徐に皮下投与する必要がある。また、注射部位に局所的な皮膚反応が生
じるといった特有の副作用や遅発性の注入後反応やその他副作用などに対しては、点滴静注製剤等と同様に適切な対応や指導が求められる。
③再評価の根
拠・有効性
ガイドライン等での位置づけ
④普及性の変化
※下記のように推定した根拠
年間対象者数の
変化
年間実施回数の
変化等
造血器腫瘍領域における皮下注射製剤は外来腫瘍化学療法診療料が算定されていないため増加が予想される。同領域においてこれまでに使用され
ている皮下注射製剤については、以前の該当領域からの提案実績を参照し、以下のように推定した。一方、今後固形癌領域で承認が見込まれる皮
下注射製剤については、現在、G001静脈内注射として外来腫瘍化学療法診療料が算定されていることから、皮下注射製剤に移行した場合であって
も症例数に大きな変化は無いと考えられる。
見直し前の症例数(人)
0人
見直し後の症例数(人)
10,000人
見直し前の回数(回)
0回
見直し後の回数(回)
100,000回
⑤医療技術の成熟度
・学会等における位置づけ
・難易度(専門性等)
・施設基準
(技術の専門性
等を踏まえ、必
要と考えられる
要件を、項目毎
に記載するこ
と)
NCCN Guidelines Breast Cancer v3.2023において、HER2陽性乳癌の標準治療であるペルツ
ズマブとトラスツズマブの併用療法に対し、配合皮下注製剤が置き換わっていくことが見
込まれている(Pertuzumab, trastuzumab, and hyaluronidase-zzxf injection for
ガイドライン等での記載あり(右欄に詳細を記載す subcutaneous use may be substituted anywhere that the combination of intravenous
pertuzumab and intravenous trastuzumab are given as part of systemic therapy
る。)
(p65))。ダラツムマブについては、経静脈的投与で生じ得る他の重篤な有害事象の多く
が頻度、程度共に低減されることから、ガイドラインでの記載はないものの、皮下投与は
既に日常診療におけるコミュニティースタンダードとして認識されている。
皮下注射による外来化学療法であっても、既に多くの場合、専門的な指導や管理を実施しており、外来における指導経験は豊富である。
【外来腫瘍化学療法診療料の施設基準に準拠】専任の医師又は看護師又は薬剤師が院内に常時1人以上配置され、本診療料を算定している患者か
施設の要件
らの副作用等に係る問い合わせ・相談に24時間対応できる連絡体制が整備されていること、 急変時等に当該患者が入院できる体制が確保されて
(標榜科、手術件数、検査や手術の体 いること、 外来化学療法を実施するための治療室を有していること、 化学療法の経験を有する専任の医師、看護師、薬剤師が勤務しているこ
制等)
と、 (外来腫瘍化学療法診療料1のみ)化学療法のレジメンの妥当性を評価・承認する委員会を開催していること。
人的配置の要件
(医師、看護師等の職種や人数、専門 上記に含む
性や経験年数等)
その他
(遵守すべきガイドライン等その他の 上記厚生労働大臣が定める施設基準に適合しているものとして地方厚生局長等に届け出た保険医療機関
要件)
⑥安全性
・副作用等のリスクの内容と頻度
腫瘍用薬における当該皮下注製剤についての安全性と副作用の情報は、静注・点滴静注製剤において得られている既知のものであり新たなリスク
はない。
⑦倫理性・社会的妥当性
(問題点があれば必ず記載)
本提案における倫理的・社会的問題は想定されない。
⑧点数等見直し
の場合
見直し前
なし
見直し後
当該皮下注製剤を皮下投与する場合に「外来腫瘍化学療法診療料」を算定可能とする。
1 外来腫瘍化学療法診療料1 イ 抗悪性腫瘍剤を投与した場合 700点、ロ 抗悪性腫瘍剤の投与その他必要な治療管理を行った場合 400点
2 外来腫瘍化学療法診療料2 イ 抗悪性腫瘍剤を投与した場合 570点、ロ 抗悪性腫瘍剤の投与その他必要な治療管理を行った場合 270点
注 15歳未満の小児の場合 200点を加算
その根拠
上記①再評価すべき具体的な内容および②現在の診療報酬上の取扱いを参照。
区分
⑨関連して減点
や削除が可能と
考えられる医療
技術(当該医療
技術を含む)
該当なし
区分をリストから選択
番号
技術名
該当なし
該当なし
具体的な内容
該当なし
増(+)
プラスマイナス
⑩予想影響額
予想影響額(円)
45,000,000円
その根拠
見直しにより算定できる点数は、「令和3年 社会医療診療行為別統計 令和3年6月審査分」より外来腫瘍化学療法診療料に相当する令和4年
度診療報酬改定以前の診療報酬のうち、外来化学療法加算1および2の算定回数を用いて、外来腫瘍化学療法診療料の診療報酬点数の加重平均を
算出したところ1回あたり720点である。見直しにより算定が不要となる点数は、がん患者指導管理料ハおよび再診料の合計として1回あたり270点
である。したがって、見直しにより算定できる点数の増分は1回あたり450点となる。これに見直し後の回数見込み100,000回を乗じて算出した。
備考
該当なし
⑪算定要件の見直し等によって、新たに使用される医薬
品、医療機器又は体外診断薬
該当なし
4064