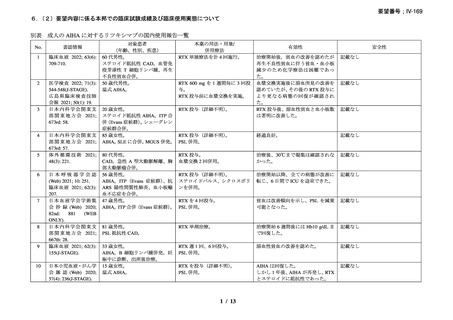
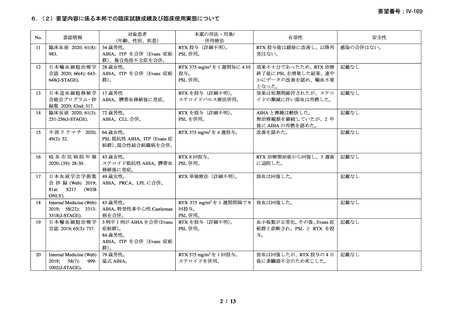
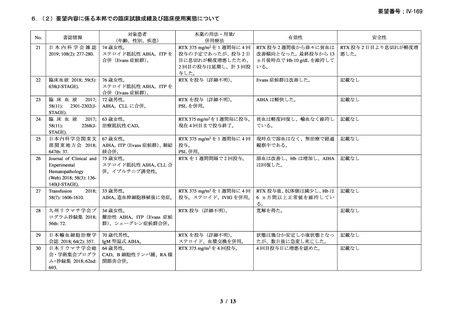
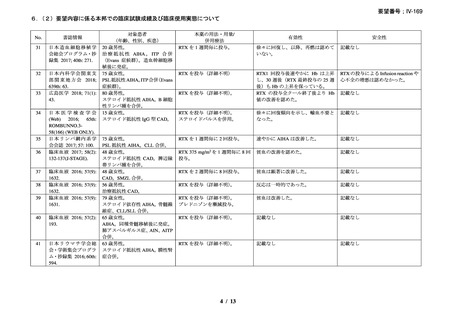
資料3-1 リツキシマブ(遺伝子組換え)[2.5MB] (99 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-169
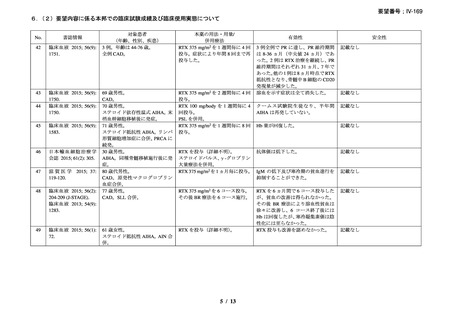
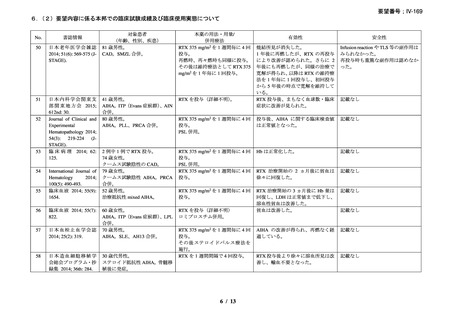
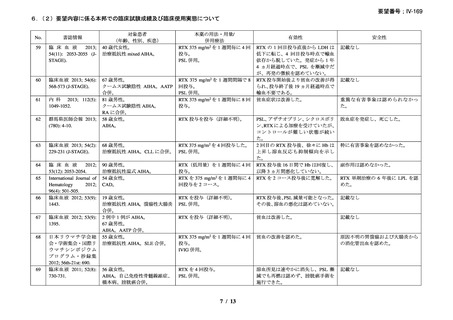
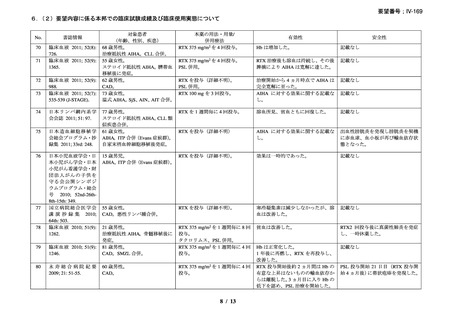
RA 及び GPA/MPA 患者に対するリツキサン投与促進のため、
JointEffort®プログラムが立ち上げられている。JointEffort®プログラム
については電話 1-888-748-8926 で確認できる。
投与できなかった場合の対応
投与できなかった場合や投与が延期される場合、それらの投与を省
略せず、予め規定した治療サイクル数及び投与間隔に基づき、医師の
判断で、後日投与する。
過剰投与
ヒトを対象とした臨床試験においてリツキサンの過剰投与を行った経
験はない。これまでに 1 回当たり 1000mg を超える投与を検討した臨
床試験はない。これまでに試験的に投与された最大投与量は、CLL 患
者に対する 5g である。その場合も新たな安全性シグナルは認められて
いない。リツキサンを過剰投与した患者については速やかに投与を中
断し、十分にモニタリングする。モニタリングでは、血液細胞数の定
期的な確認の必要性や、患者の B 細胞数が枯渇している間の感染症発
現リスクの上昇を考慮する。
リツキサンの過剰投与が疑われる場合には地域の毒物管理センター
に連絡すること。
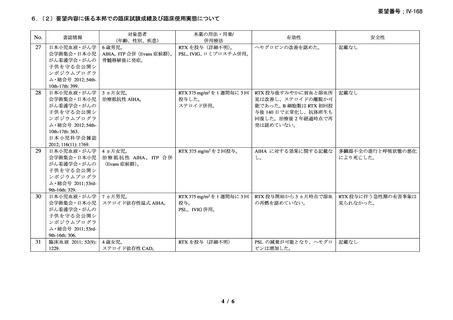
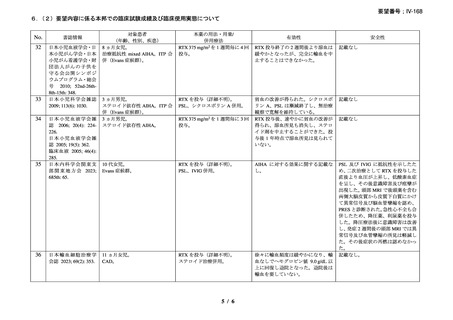
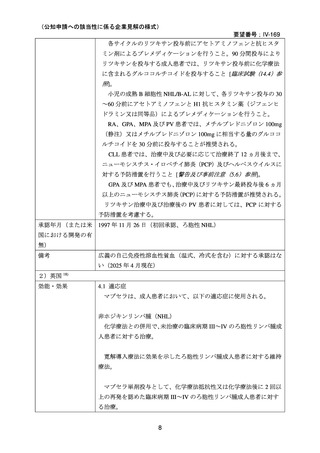
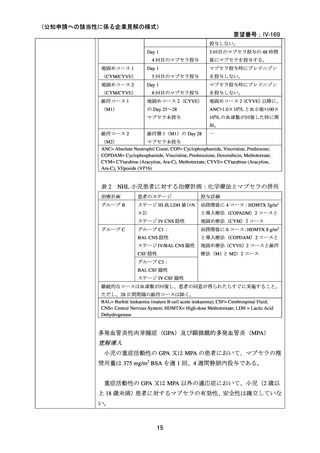
承認年月(または加 2000 年 5 月 17 日(初回承認、ろ胞性 NHL)
国における開発の有
無)
備考
広義の自己免疫性溶血性貧血(温式、冷式を含む)に対する承認はな
い(2025 年 4 月現在)
6)豪州
効能・効果
用法・用量
承認年月(または豪 1998 年 8 月 21 日にろ胞性 NHL で初回承認を取得したが、2022 年 2
州における開発の有 月 25 日で販売が終了している。
無)
備考
(2)
欧米等6カ国での標準的使用状況について
1)米国
26