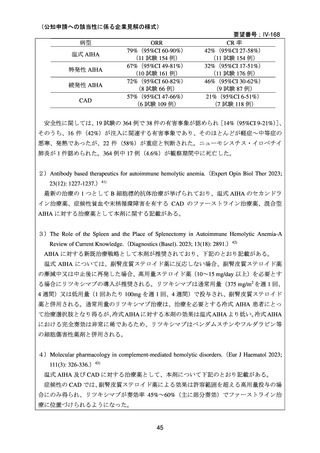
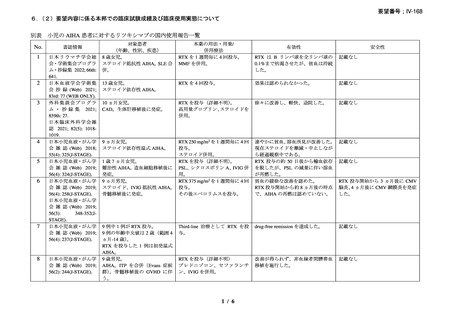
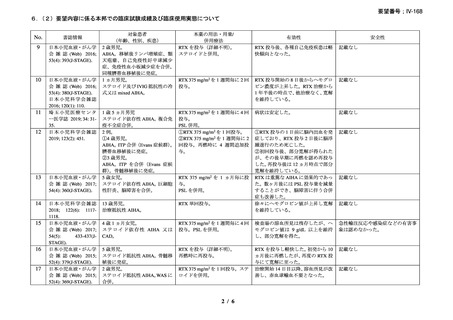
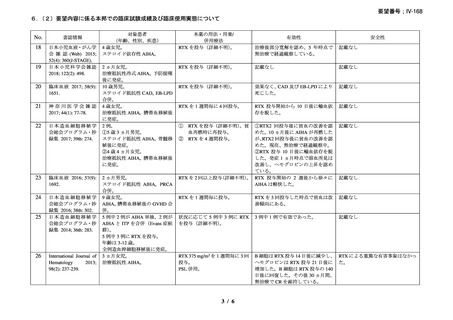
資料3-1 リツキシマブ(遺伝子組換え)[2.5MB] (108 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-169
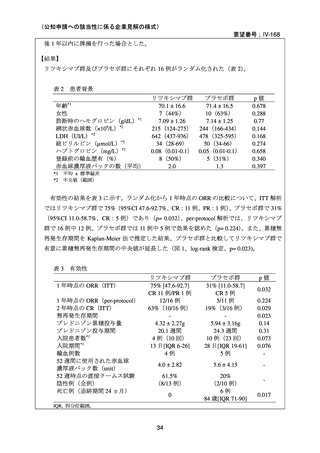
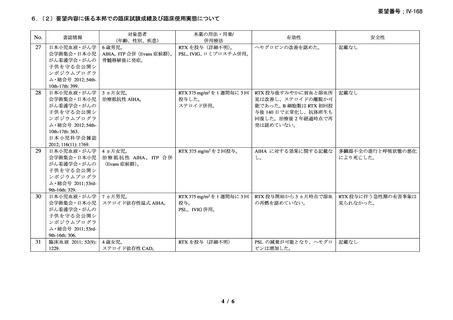
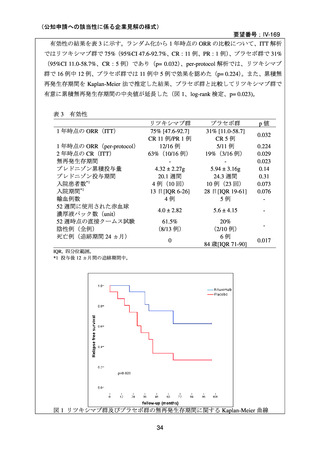
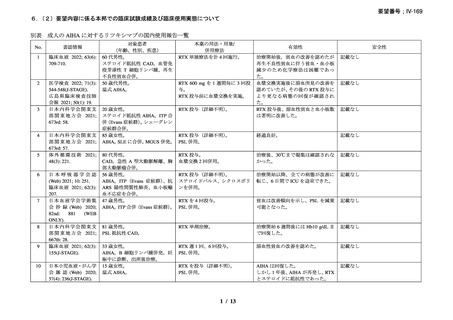
安全性について、両群で infusion reaction は認めなかった。重篤な有害事象がプラセボ群
で 7 例 10 件、リツキシマブ群で 3 例 4 件認められた。リツキシマブ群の 2 例において、初
回投与後 8 週間から 4 ヵ月の間に grade 3 の好中球減少症を認めた。また、2 例で重症感染
症(肺炎)を認め、1 例はニューモシスチス・イロベチイ肺炎、他の 1 例は肺胞性肺炎と
診断された。プラセボ群の重篤な有害事象のほとんどが重症感染症であり、一部の事象は
致死的であり、また、1 例では広範な肺塞栓を認めた。
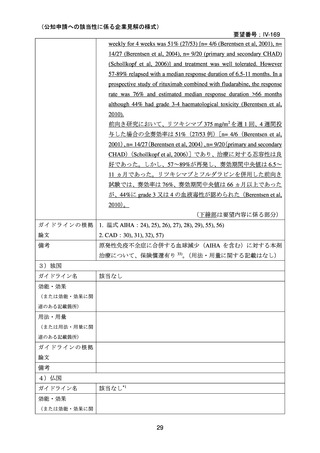
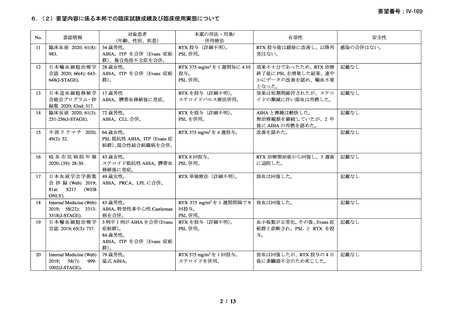
3)温式 AIHA を対象としたリツキシマブ投与に関する後方視的解析(英国診療ガイドラ
イン引用文献)25)
本剤投与を受けた温式 AIHA 患者 27 例を対象に、後方視的解析が行われた。女性が 16
例(59%)
、平均年齢が 49.7 ± 21 歳、診断時のヘモグロビン中央値が 5.9 g/dL(範囲 2.2-9.8
g/dL)
、特発性の温式 AIHA が 17 例(63%)
、続発性の温式 AIHA が 10 例(37%)であり、
27 例中 6 例が Evans 症候群と診断された。先行治療として 2.1 ± 1.4 種類の治療が行われ、
全例で副腎皮質ステロイド薬が投与され、7 例(26%)で免疫抑制薬の投与、6 例で脾摘が
行われていた。17 例で赤血球濃厚液の輸血が行われていた。
診断時から本剤投与までの期間は 40.3 ± 22 ヵ月で、24 例では 375 mg/m2 を週 1 回 4 回投
与、2 例で有害事象により 2 回又は 3 回投与、他の 1 例では 2 週間間隔で 1,000mg を 2 回
投与した。本剤投与の理由は、ステロイド治療抵抗性(プレドニゾン 1 mg/kg/day 以上の 2
週間投与で奏効を認めない)のためが 5 例(19%)
、ステロイド依存性(プレドニゾン 10
mg/day 超を継続)のためが 16 例
(59%)、
初回 PR 又は CR 後の再発に対する治療が 6 例
(22%)
であった。本剤投与時、26 例で経口副腎皮質ステロイド薬が投与されており、2 例でアザ
チオプリン、1 例でミコフェノール酸 モフェチル(以下、MMF)が投与されていた。
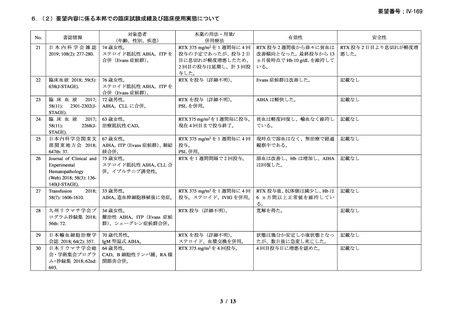
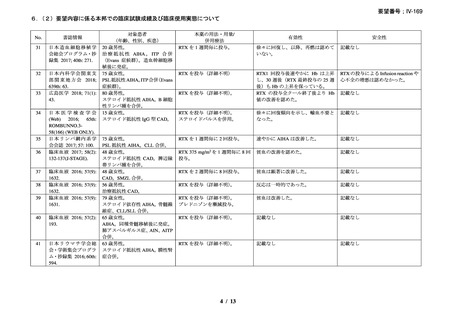
本剤の有効性は 25 例(93%)で認められ、CR(治療中止で溶血の徴候を認めずヘモグロ
ビン値が 11 g/dL 超(女性)/12 g/dL 超(男性))が 8 例(30%)、PR[輸血を実施せずヘモ
グロビン値が治療開始前から 2 g/dL 以上上昇し 10 g/dL 超、治療中止又はプレドニゾン 10
mg/day 以下の投与で、溶血の徴候(ハプトグロビン低値又は/及び LDH 高値)が持続]が
17 例(63%)であった。本剤投与開始から 1 ヵ月以内に 14 例(56%)で効果の発現を認め
(効果発現までの期間中央値:6 週間、範囲:2-16 週間)、奏効例では輸血が不要であった。
ヘモグロビン中央値は、治療開始前と比較して本剤投与後で改善を認め(8.3 g/dL [2.2-12.9]
から 13.3 g/dL [11.3-15.5]、p< 0.0001)
、本剤投与時と比較して最終観察時点では、ビリルビ
ン平均値の改善を認め(3.1 mg/dL から 0.82 mg/dL、p< 0.0001)
、網状赤血球数平均値は減
少した(276×109/L から 120×109/L、p< 0.0001)
。本剤初回投与からの追跡期間平均 20.9 ±
10.2 ヵ月時点で 25 例中 18 例が奏効を維持しており、11 例が副腎皮質ステロイド薬を中止
し、5 例で再発し、2 例の死亡を認めた。3 例で本剤再治療が行われ、1 例が CR、2 例で PR
を認めた。1 例では、本剤の再投与が約 1 年毎に 3 回行われ、それぞれで PR を認めた。奏
効を認めなかった 2 例のうち 1 例は、B 細胞性非ホジキンリンパ腫を併存し、脾摘により
35