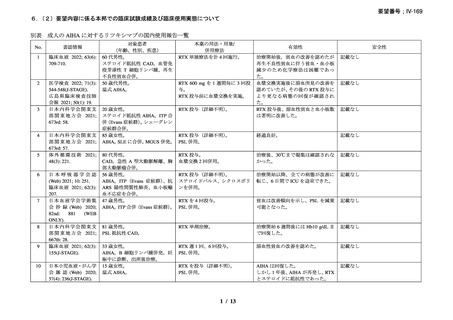
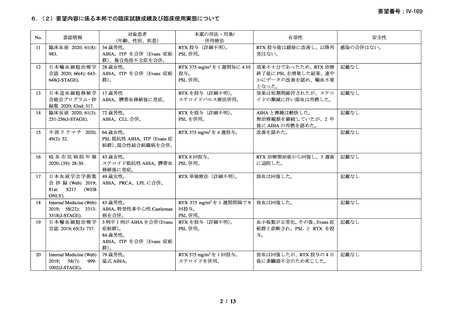
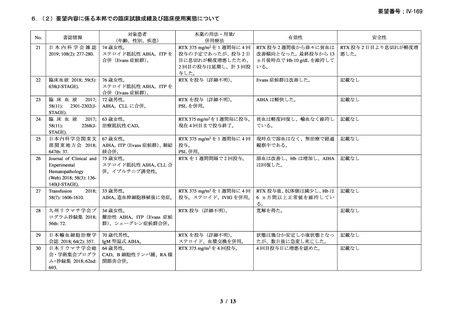
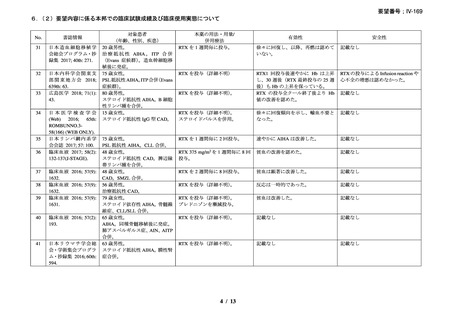
資料3-1 リツキシマブ(遺伝子組換え)[2.5MB] (62 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-168
性の B 細胞性悪性リンパ腫及び免疫抑制状態下の CD20 陽性の B 細胞性リンパ増殖性疾患の
範囲内であり、多発血管炎性肉芽腫症及び顕微鏡的多発血管炎、慢性特発性血小板減少性紫
斑病、後天性血栓性血小板減少性紫斑病、全身性強皮症、難治性ネフローゼ症候群(なお、
ネフローゼ症候群では、1 回あたりの最大投与量を 500mg までとしている)
、及び既存治療で
効果不十分なループス腎炎の用法・用量と同一であり、日本人における安全性情報の蓄積も
ある。
なお、免疫抑制状態下の CD20 陽性の B 細胞性リンパ増殖性疾患、慢性特発性血小板減少
性紫斑病、難治性ネフローゼ症候群、及び既存治療で効果不十分なループス腎炎に対する本
剤の当該用法・用量は小児への投与も想定されている。
したがって、「自己免疫性溶血性貧血」を効能・効果とする場合の用法・用量は、「通常、
リツキシマブ(遺伝子組換え)として 1 回量 375 mg/m2 を 1 週間間隔で 4 回点滴静注する。」
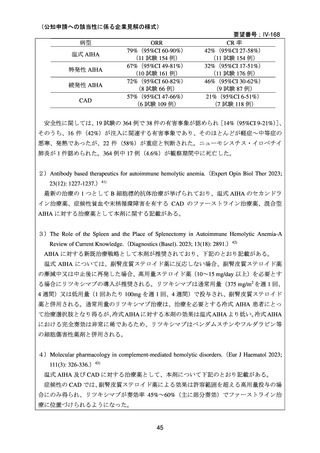
と設定することが妥当と考える。
(3)上記(1)及び(2)以外の添付文書の記載内容について
1)国内外の添付文書の記載内容(注意喚起等)の異同について
欧米等 6 ヵ国及び本邦において、小児の AIHA に対して本剤は承認されていないことから、
いずれの国の添付文書においても本要望に関する記載はない。
2)上記1)以外で本邦の添付文書上で改訂が必要と考えられる箇所の有無について
「7.公知申請の妥当性について(2)要望内容に係る外国人におけるエビデンス及び日
本人における安全性の総合評価について」に示したとおり、小児の AIHA 患者に対して本剤
を投与した場合に報告された有害事象の多くは、本剤に特徴的な有害事象として既に添付文
書で注意喚起されている事象の範囲と考えられ、小児の AIHA 患者に対する本剤の投与に際
し、現状より安全性上の懸念が高まる恐れはないと考える。したがって、現状では本剤の安
全性に関する新たな注意喚起は不要であり、特に改訂を要する箇所はないと考える。
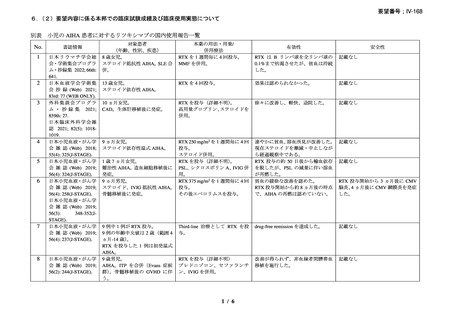
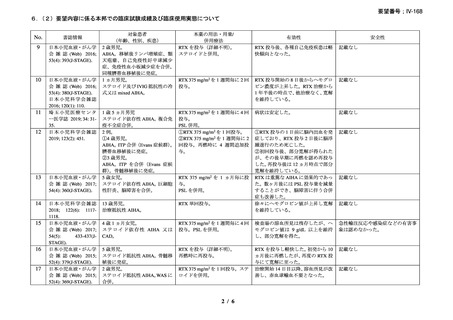
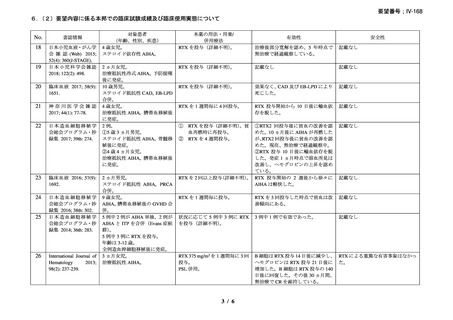
9.要望内容に係る更なる使用実態調査等の必要性について
(1)要望内容について現時点で国内外のエビデンスまたは臨床使用実態が不足している点
の有無について
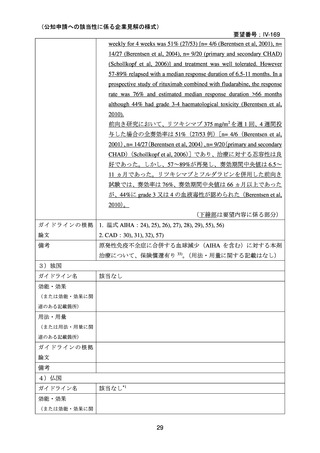
本剤は、英国の診療ガイドラインにて、ファーストライン治療である副腎皮質ホルモン薬
に抵抗性を示す温式 AIHA に対するセカンドライン治療として、CAD に対してはファースト
ライン治療薬としてそれぞれ推奨されており 15)、小児の AIHA に対する治療法は成人の場合
と同様とされている。また、現状では国内の診療ガイドラインにおいても本剤は英国の診療
ガイドラインと同様の位置づけがなされている 1)。なお、温式 AIHA 患者のうち、特定の患
者(重症例、副腎皮質ステロイド薬の長期投与を避ける必要がある患者等)ではファースト
ライン治療 47), 48), 57), 58), 59)で、本剤の使用が考慮される。
58