資料3-1 リツキシマブ(遺伝子組換え)[2.5MB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-168、IV-169
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
リツキシマブ(遺伝子組換え)
広義の自己免疫性溶血性貧血(温式、冷式を含む)
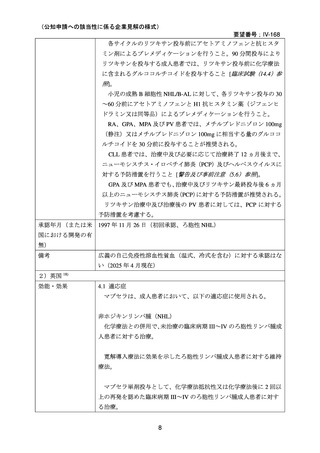
1.要望内容の概略について
要 望 さ れ 一般名:リツキシマブ(遺伝子組換え)
た医薬品
販売名:リツキサン点滴静注 100 mg、同点滴静注 500 mg
会社名:全薬工業株式会社
要望者名
一般社団法人 日本血液学会
要望内容
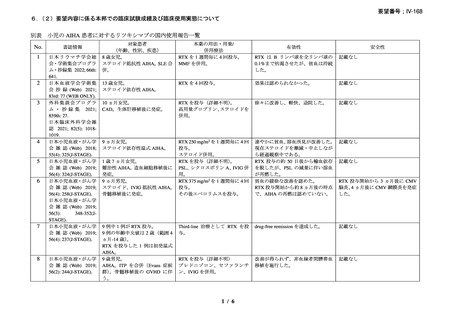
効能・効果
広義の自己免疫性溶血性貧血(温式、冷式を含む)
用法・用量
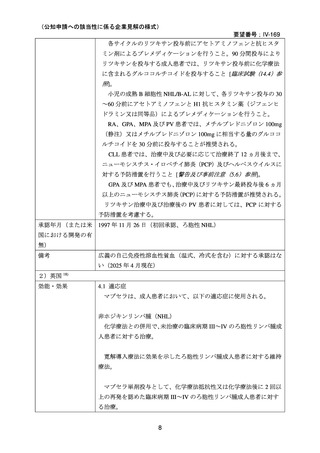
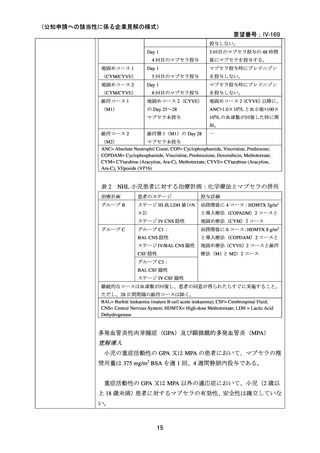
リツキシマブ(遺伝子組換え)として 1 回量 375 mg/m2 を 1
週間間隔で計 4 回点滴静注する。
効能・効果及び なし
用法・用量以外
の要望内容(剤
形追加等)
備考
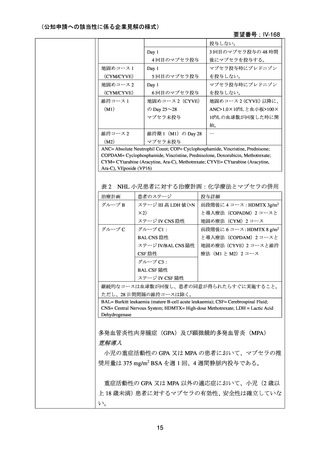
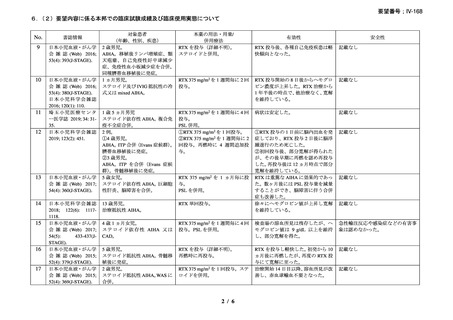
2.要望内容における医療上の必要性について
第 58 回医療上の必要性の高い未承認薬・適応外薬検討会議(令和 6 年 3 月 22 日)にお
いて、別添のとおり医療上の必要性の基準に該当すると判断した。
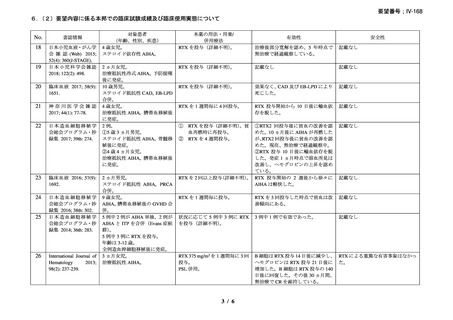
3.公知申請の妥当性について
企業見解を提出した企業は、公知申請の妥当性について下記のとおり説明している。
•
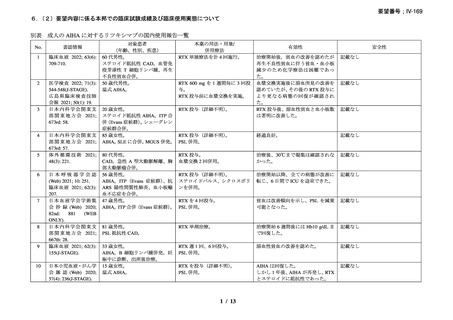
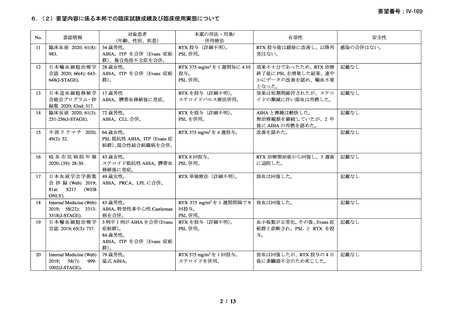
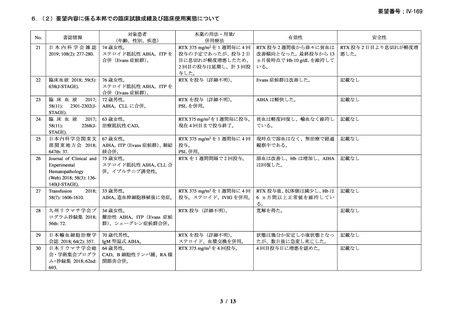
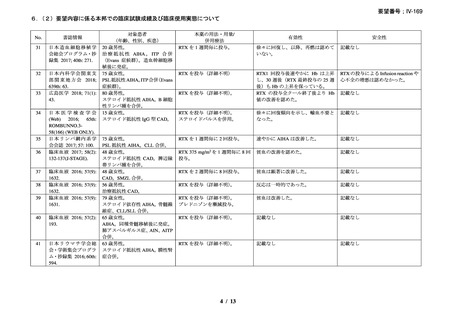
有効性について、別紙 1 の企業見解 p.55 及び別紙 2 の企業見解 p.50 記載のとおり、
海外の臨床試験成績、国内外の教科書、診療ガイドライン及び症例報告等から、成人
及び小児における温式又は冷式の自己免疫性溶血性貧血に対するリツキシマブ(遺
伝子組換え)
(以下、「本薬」)の有効性は期待できる。
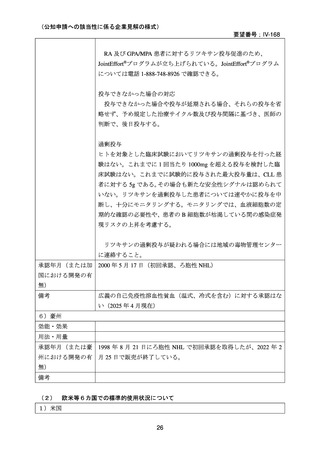
•
安全性について、別紙 1 の企業見解 p.55 及び別紙 2 の企業見解 p.51 に記載のとお
り、温式又は冷式の自己免疫性溶血性貧血の治療に本薬を用いた際の安全性は、温
式又は冷式の自己免疫性溶血性貧血の治療に十分精通している医師のもとで、既承
認の効能・効果と同様の適切な安全対策をとった上であれば、本薬の既知の安全性
情報の範囲内と推定できる。
1