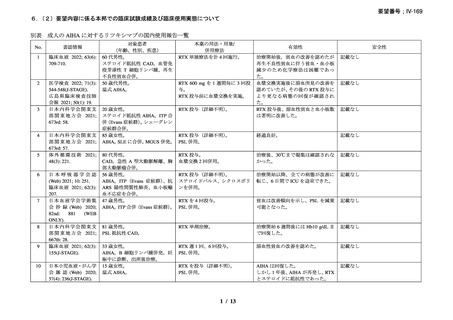
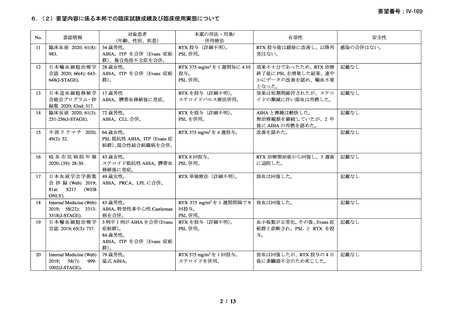
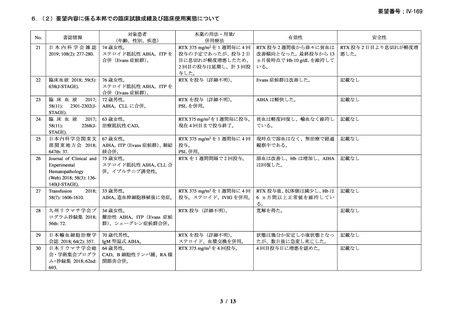
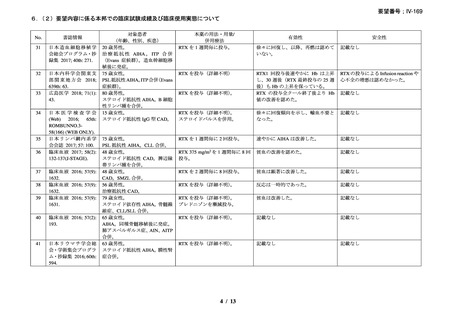
資料3-1 リツキシマブ(遺伝子組換え)[2.5MB] (90 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-169
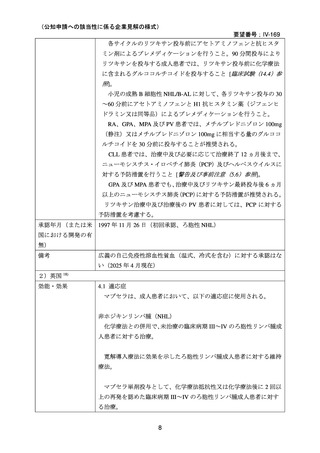
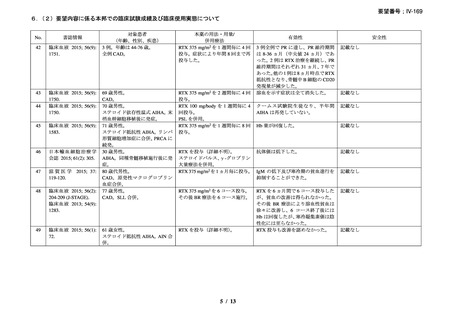
小児患者―非ホジキンリンパ腫
初回投与
推奨される最初の注入速度は 0.5 mg/kg/時(最大で 50 mg/時)
;過敏
症又は infusion-related reaction の発現がない場合には、30 分毎に 0.5
mg/kg/時ずつ、最大 400 mg/時まで注入速度を増加させる。
2 回目以降の投与
マブセラの 2 回目以降の投与時の最初の注入速度は 1 mg/kg/時(最
大で 50 mg/時)
;30 分毎に 1 mg/kg/時ずつ、最大 400 mg/時まで注入速
度を増加できる。
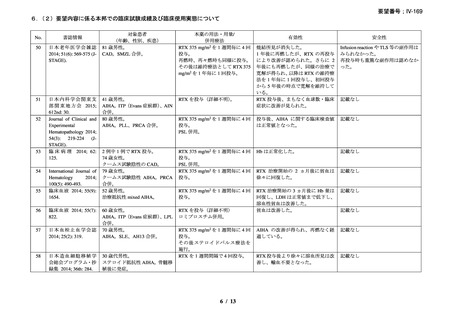
関節リウマチ
初回投与後に使用できる急速投与スケジュール
初回投与以降に標準的投与スケジュールでマブセラ 1000mg を投与
し、重篤な infusion-related reaction を発現しなかった患者では、2 回目
以降の投与において、以前投与を行った時と同じ希釈濃度(4 mg/mL
で全量 250mL)を使用して、急速投与ができる。250 mg/時で 30 分間
投与した後、600 mg/時で 90 分間投与する。急速投与で忍容性が認め
られた場合、その後の投与は、この急速投与スケジュールで行うこと
ができる。
不整脈を含む臨床的に注意が必要な心血管障害を有する患者や、生
物学的製剤やマブセラによる過去の治療で重篤な infusion reaction を認
めた患者では、急速投与は行わない。
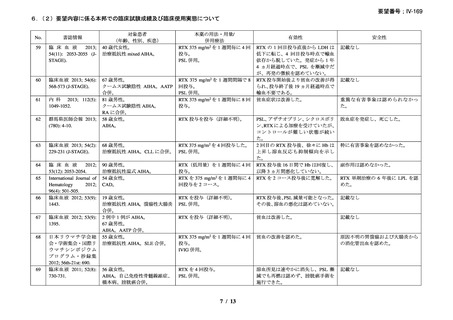
承認年月(または英 1998 年 6 月 2 日(中央審査方式)
(初回承認、ろ胞性 NHL)
国における開発の有
無)
備考
広義の自己免疫性溶血性貧血(温式、冷式を含む)に対する承認はな
い(2025 年 4 月現在)
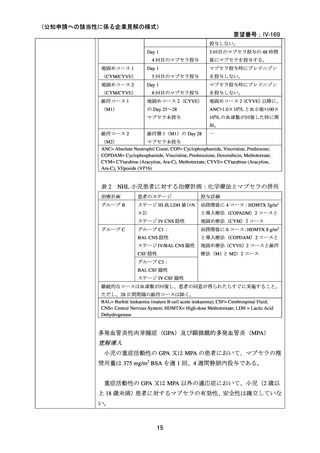
3)独国 18)
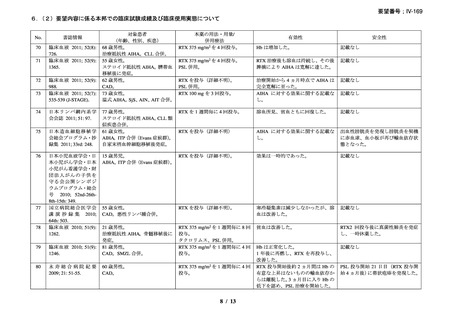
効能・効果
中央審査方式による承認のため、英国と同様。
用法・用量
中央審査方式による承認のため、英国と同様。
承認年月(または独 1998 年 6 月 2 日(中央審査方式)
(初回承認、ろ胞性 NHL)
国における開発の有
無)
備考
広義の自己免疫性溶血性貧血(温式、冷式を含む)に対する承認はな
い(2025 年 4 月現在)
17