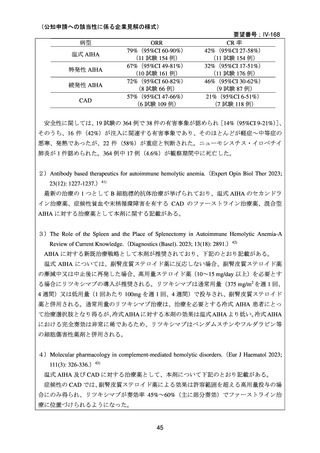
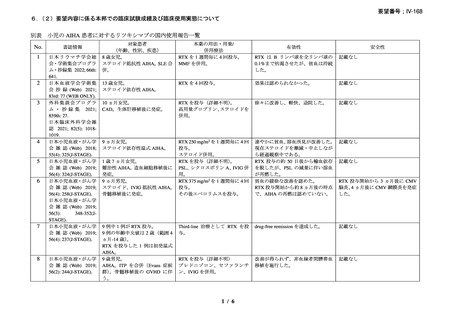
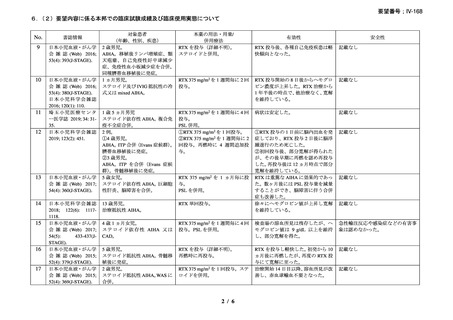
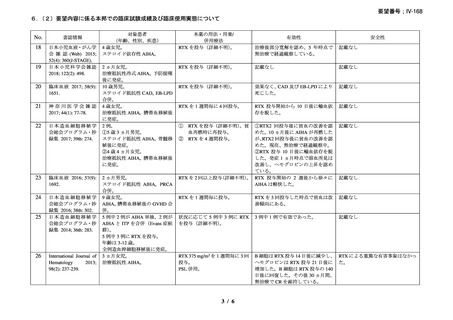
資料3-1 リツキシマブ(遺伝子組換え)[2.5MB] (112 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-169
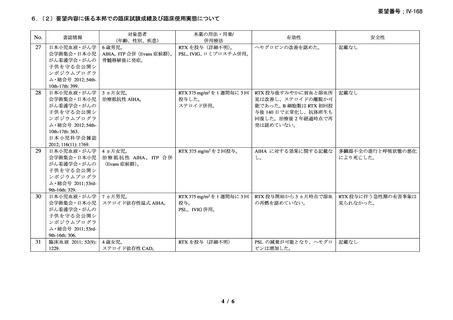
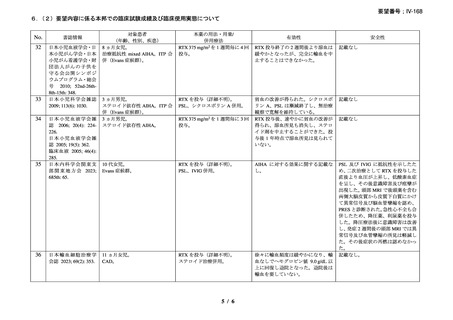
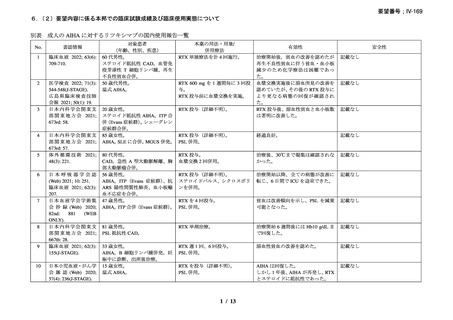
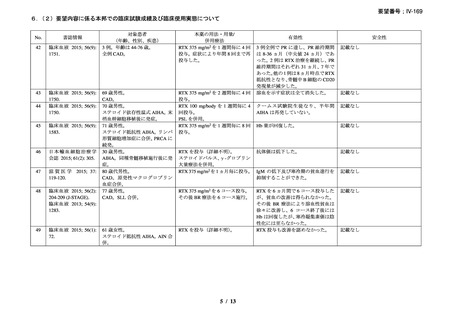
慢性溶血を認め、寒冷凝集素力価が 64 以上及び直接クームス試験の典型的なパターン
(C3 強陽性、IgG 陰性又は弱陽性)を示し、治療を要する臨床症状(貧血、レイノー症状)
を認める CAD 患者を対象とした。また、血清中の IgMκ バンドと骨髄中の CD20+κ+のクロ
ーナルな増殖により定義される CD20+κ+のクローナルなリンパ増殖による血清又は骨髄異
常を確認した。なお、続発性 CAD 患者は除外した。
本剤は 375 mg/m2 を週 1 回、4 回投与し、治療開始から 3 ヵ月以内に効果を認めない場合
や試験中に再発を認めた場合には、本剤(375 mg/m2 を週 1 回、4 回投与)とインターフェ
ロン(IFN)(500 万単位を週 3 回、20 週間)の併用療法を実施した。
有効性評価の定義について、CR は貧血及び溶血の徴候を認めず、臨床症状が消失し、モ
ノクローナル血清タンパクを認めず、骨髄組織検査でクローナルなリンパ増殖を認めない
場合とし、PR はヘモグロビン値が 20 g/L 以上安定的に上昇又は正常化し、血清 IgM が 50%
以上減少又は正常化し、臨床的な症状が改善し、輸血の離脱が可能な場合とし、CR 及び
PR に該当しない場合は非奏効とした。
27 例に 37 コースの本剤治療が実施された。18 例が女性、平均年齢が 71 歳(範囲 51-91
歳)
、12 例が未治療で、10 例で 1 種類の治療が実施されており、5 例で 2 種類以上の治療
が実施されていた。ベースラインのヘモグロビン値中央値は 82 g/L(範囲 62-123)
、IgM 値
中央値は 5.0 g/L(範囲 0.6-51.7)
、寒冷凝集素力価(4℃)中央値は 6,000(範囲 64-256,000)
、
骨髄の κ/λ 比中央値は 8.4(範囲 4.7-77.0)であり、リンパ形質細胞性リンパ腫が 15 例、辺
縁帯細胞リンパ腫が 2 例、小リンパ球性リンパ腫(B 細胞)が 2 例、非特異的でクローナ
ルなリンパ増殖が 6 例、反応性のリンパ球浸潤/非クローナルなリンパ増殖性障害が 2 例
であった。
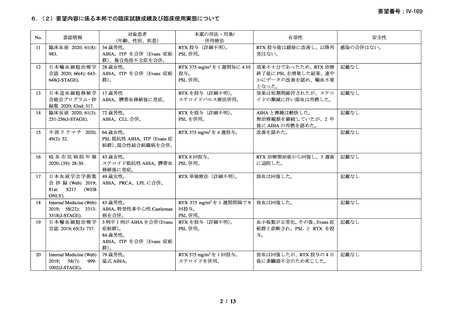
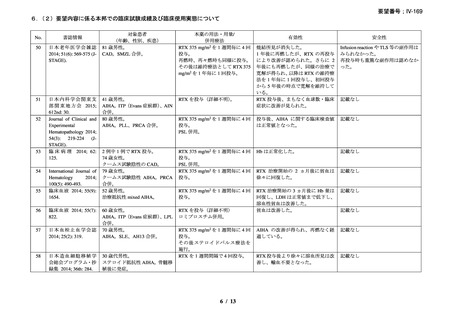
27 例中 14 例で本剤のファーストライン治療が奏効し(CR が 1 例、PR が 13 例)
、効果
を認めなかった 2 例に対して本剤と IFN の併用治療が行われ、1 例が PR、1 例では効果を
認めなかった。8 例で再発を認め、3 例に本剤と IFN の併用治療が行われ、5 例に対して本
剤単剤治療が行われ、5 例で PR を認め、3 例では効果を認めなかった。2 例では 2 回目の
再発に対して本剤単剤治療を実施し、PR を認めた。本剤治療は合計 37 コース実施され、
CR が 1 コース、PR が 19 コースで認められ、効果を認めるまでの期間中央値は 1.5 ヵ月(範
囲 0.5-4.0 ヵ月)であった。
奏効を認めた 17 例の奏効期間(奏効を認めた後の再発又は 12 ヵ月を超える場合)中央
値は、11 ヵ月(範囲 2-42 ヵ月)であり、1 例(28 ヵ月後に PR を維持)を除きその他の症
例では 12 ヵ月を超えた時期で再発を認めた。CR を認めた症例では 42 ヵ月間、奏効を維持
した。12 例で本剤治療後に骨髄障害の消失を認めた。
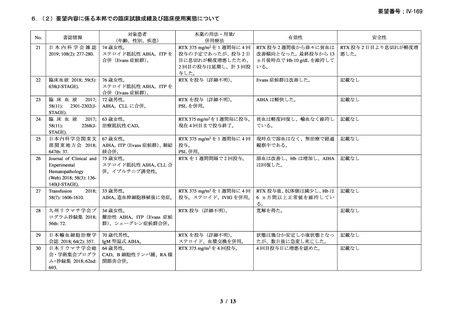
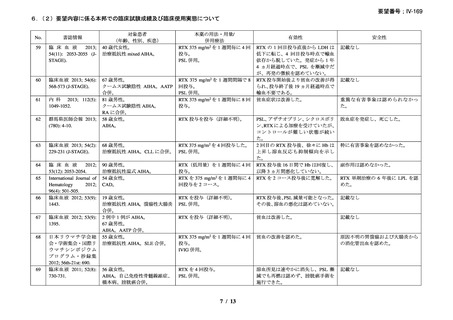
重篤な infusion reaction の発現は認められなかったが、1 例で本剤初回投与時に筋肉痛を
認めた。本剤に関連のある血液毒性が 1 例(grade 4 の好中球減少症、grade 2 の発熱、grade
1 の感染症)に認められた。本剤単剤治療が無効であった 2 例が、治療と関係ない疾患に
よりそれぞれ治療後 4 ヵ月、12 ヵ月で死亡したが、その他の症例については治療後 3~43
ヵ月時点で生存を認めている。
39