資料3-1 リツキシマブ(遺伝子組換え)[2.5MB] (111 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-169
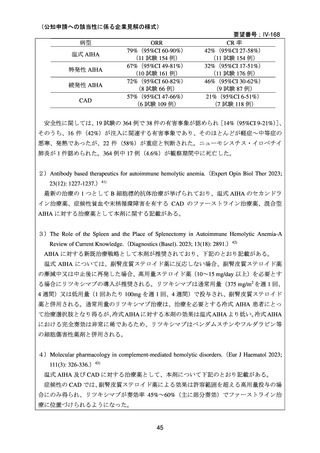
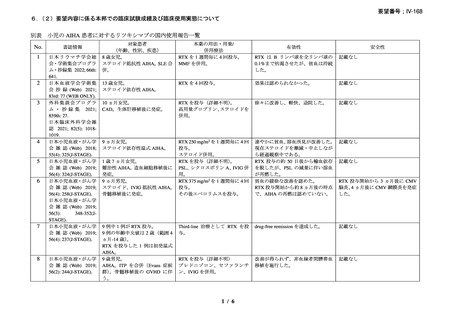
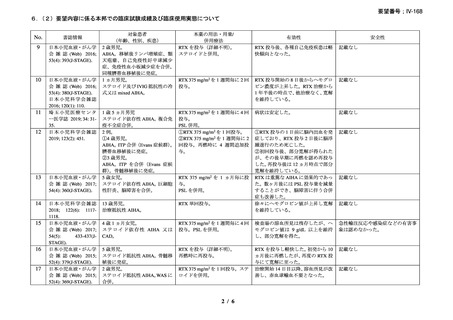
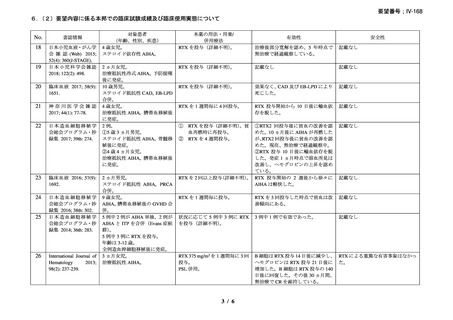
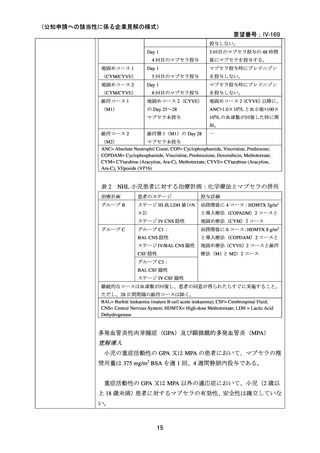
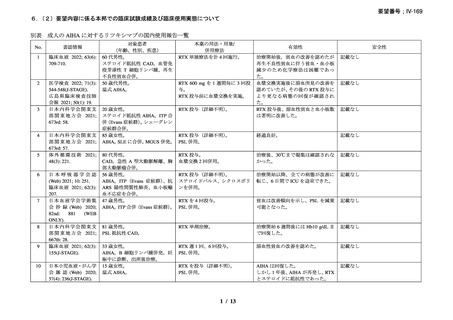
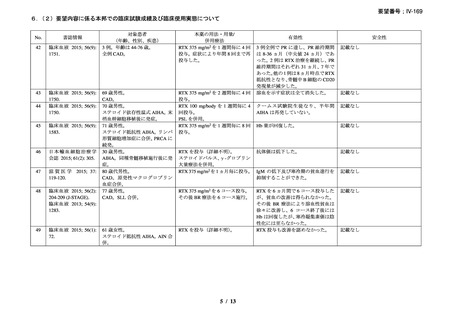
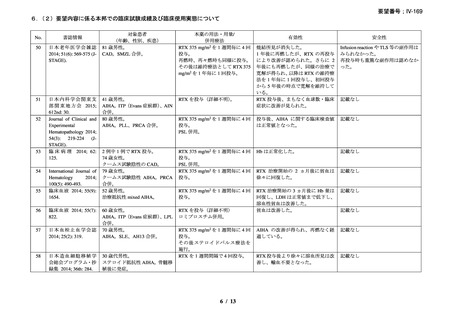
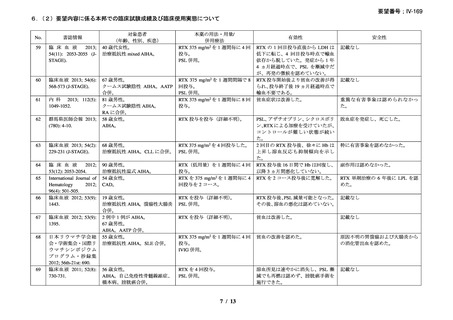
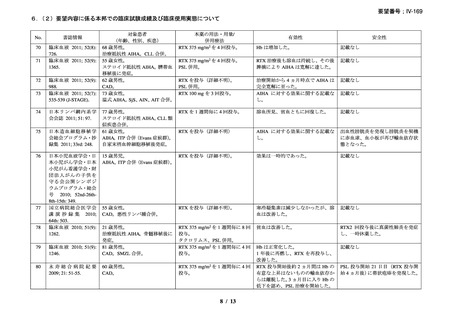
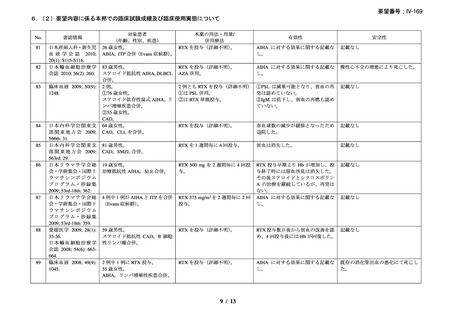
臨床及び生化学的に溶血の徴候を認め、寒冷凝集素力価が 64 以上及び直接クームス試験
の典型的なパターン(C3 陽性、IgG 陰性)を示した CAD 患者を対象とした。なお、特発
性又は基礎疾患としてリンパ増殖性 B 細胞障害の有無を確認した。本剤は 375 mg/m2 を週
1 回、4 週間投与した。
有効性評価の定義について、CR はヘモグロビン値が正常化し、溶血の徴候(モノクロー
ナルな IgM を含む)を認めず、CAD の臨床症状が消失した場合とし、PR はヘモグロビン
値が 1 ヵ月間以上 1.0 g/dL 以上の上昇を認めており、輸血が不要、CAD の臨床症状が改善
し、血清 IgM が高値の症例では 50%以上の低下を認めた場合とし、CR 及び PR に該当しな
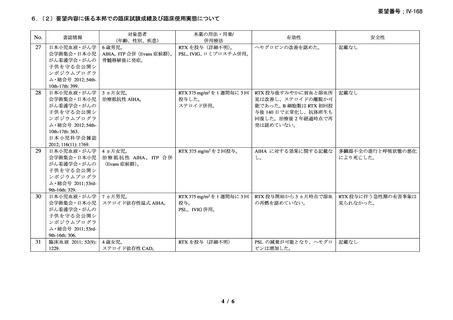
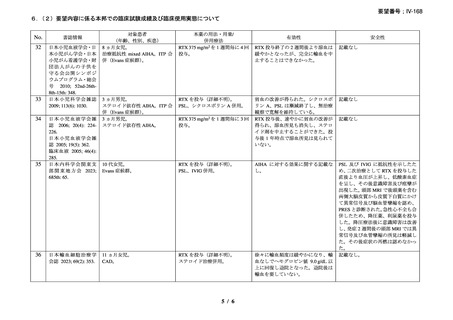
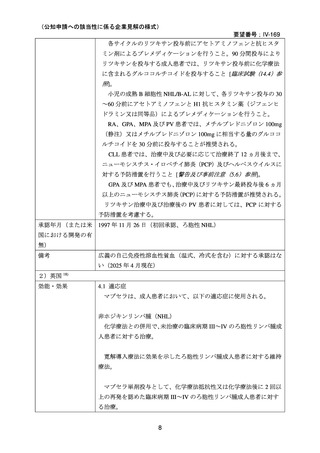
い場合は非奏効とした。
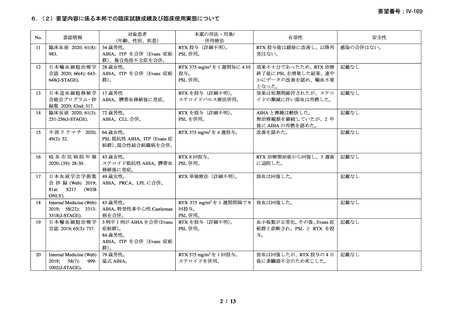
20 例が登録され、15 例が女性、年齢中央値が 75 歳(範囲 54-86 歳)
、11 例で登録前 3 ヵ
月の間に輸血を実施しており、12 例が特発性、3 例がリンパ形質細胞性リンパ腫、2 例が
小リンパ球性リンパ腫、2 例が非特異的なリンパ増殖疾患を認めた(1 例は骨髄検査未実施
のため特発性とされた)。9 例が未治療例、2 例が副腎皮質ステロイド薬の治療歴があり、8
例はクロラムブシル単剤又は副腎皮質ステロイド薬との併用治療が行われており、1 例は
クロラムブシルとシクロホスファミドの併用治療が行われていた。診断時のヘモグロビン
値中央値は 10.3 g/dL(範囲 7.3-15.3)であった。
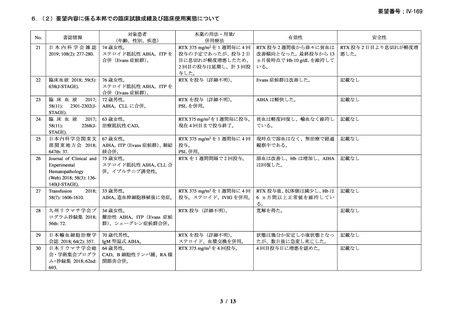
16 例で 1 年以上追跡が行われ、4 例が CAD とは関連しない理由で早期に試験を中止した
[直腸がん、腎不全を合併した敗血症、肺炎(死亡)
、不明(死亡)]。9 例(45%)が奏効
し、1 例が CR、8 例が PR であった。リンパ増殖性疾患 7 例のうち 5 例(71%、PR 5 例)
、
特発性 CAD 13 例のうち 4 例(31%、CR 1 例、PR 3 例)で奏効を認めた。最大効果を認め
るまでの期間中央値は 3 ヵ月(範囲 1-5 ヵ月)であった。非奏効例の 1 例で本剤の再投与
が行われたが、奏効を認めず、別の 1 例では溶血が改善しヘモグロビン値の回復を認めた
ものの PR には至らず、本剤再投与(2 回投与)を行い溶血の消失を認めた。また、続発性
CAD の症例では、全例で骨髄の組織学的評価で CR 又は PR を認めた(有効性の評価が非
奏効の症例も含む)
。
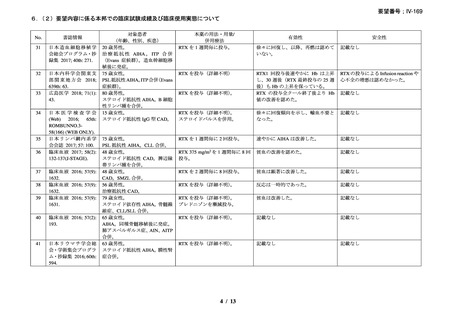
奏効を認めた 9 例中 6 例で追跡期間の 48 週間のうちに再発を認め、奏効期間中央値は
6.5 ヵ月(範囲 2-10 ヵ月)であり、奏効を維持していた 1 例(PR)は 48 週時の最終観察以
降も奏効を維持し、残りの 2 例(いずれも PR)は奏効を認めた 14 ヵ月後に再発を認めた。
本剤の忍容性は良好であり、重症の infusion reaction は認めなかった。8 例で発熱、咳嗽、
頭痛、悪心、下痢、振戦又は眩暈を認めたが、全症例が対症療法なく治癒した。また、3
例で生理食塩水注入時の低血圧を認めた。治療の中止が必要となる症例は認められなかっ
た。
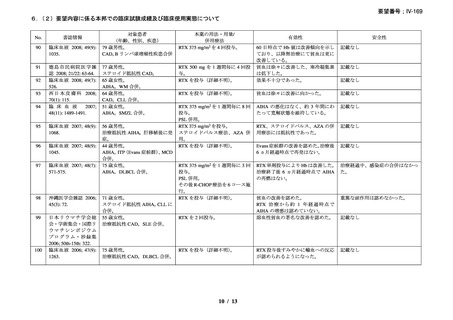
2)CAD を対象としたリツキシマブの有効性及び安全性を確認する臨床第 II 相試験(英国
診療ガイドライン引用文献)31)
CAD 患者に対する本剤の有効性と安全性を確認する多施設共同(ノルウェーの 10 施設)
、
臨床第 II 相試験が実施され、2001 年 10 月から 2003 年 5 月に被験者 27 例が登録された。
38