よむ、つかう、まなぶ。
参考資料1 各臨床研究中核病院の活動報告及び特色紹介 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_62409.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第44回 8/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
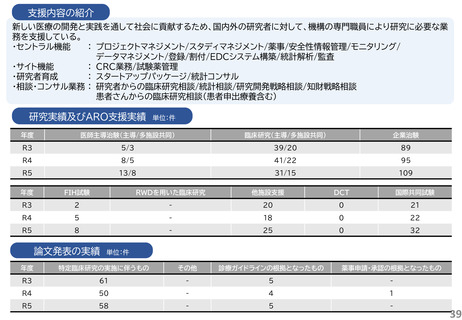
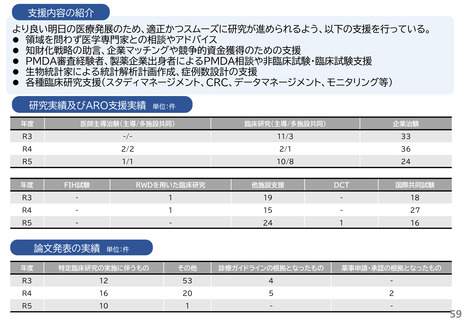
ベンチャー企業への支援実施状況
医療系ベンチャー支援窓口を設置し、相談内容に応じてARO内の各専門家と協議し、具体的な支援戦略の企画・立案を行い、シーズ
開発・知財支援室においてベンチャー設立支援、資金調達、知財戦略、研究支援の企画・立案、薬事対応など必要な支援を実施する。ま
た、学内の産学連携部門のほか、他大学や地方自治体のベンチャー支援部署、VC、MEDISO等と連携し協働する体制にある。スター
トアップ企業、スタートアップを目指す研究者および大学の起業サークルを対象とした講演会やセミナー開催等を通じたベンチャー育
成活動も実施している。
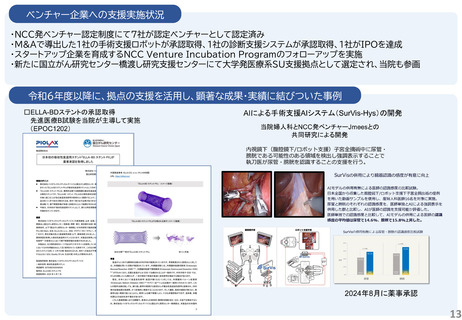
令和6年度以降に、拠点の支援を活用し、顕著な成果・実績に結びついた事例
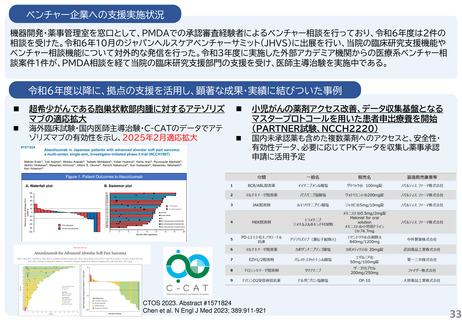
1.企業と連携し、薬事承認申請に向けて大きく進捗した課題: 膝又は肘の関節軟骨損傷に対する軟骨修復材によ
る治療法開発
北海道大学と持田製薬で共同開発(基礎研究および臨床試験を共同で実施)された膝又は肘の関節軟骨損傷に
対する軟骨修復材(アルギン酸)が2025年6月 厚生労働省 薬事審議会医療機器・体外診断部会にて製造販売承認
が了承された。
2.患者申出療養の試験: BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラフェニブ・トラメ
チニブの第II相試験
海外で承認を取得しているが日本では未承認であったダブラフェニブ・トラメチニブの小児固形腫瘍に対する経
口投与の有効性と安全性を検討することを目的とし、2023年1月に患者申出療養として実施が認められた。当院
で9例の患者さんが参加した。2023年11月に小児へ適応が拡大され、2024年11月に小児用製剤が承認された
ため、患者申出療養を終了した。承認までの空白期間(ドラッグ・ラグ)において、患者さんに治療の選択肢を提供す
る橋渡しの役割を果たした。
5
医療系ベンチャー支援窓口を設置し、相談内容に応じてARO内の各専門家と協議し、具体的な支援戦略の企画・立案を行い、シーズ
開発・知財支援室においてベンチャー設立支援、資金調達、知財戦略、研究支援の企画・立案、薬事対応など必要な支援を実施する。ま
た、学内の産学連携部門のほか、他大学や地方自治体のベンチャー支援部署、VC、MEDISO等と連携し協働する体制にある。スター
トアップ企業、スタートアップを目指す研究者および大学の起業サークルを対象とした講演会やセミナー開催等を通じたベンチャー育
成活動も実施している。
令和6年度以降に、拠点の支援を活用し、顕著な成果・実績に結びついた事例
1.企業と連携し、薬事承認申請に向けて大きく進捗した課題: 膝又は肘の関節軟骨損傷に対する軟骨修復材によ
る治療法開発
北海道大学と持田製薬で共同開発(基礎研究および臨床試験を共同で実施)された膝又は肘の関節軟骨損傷に
対する軟骨修復材(アルギン酸)が2025年6月 厚生労働省 薬事審議会医療機器・体外診断部会にて製造販売承認
が了承された。
2.患者申出療養の試験: BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラフェニブ・トラメ
チニブの第II相試験
海外で承認を取得しているが日本では未承認であったダブラフェニブ・トラメチニブの小児固形腫瘍に対する経
口投与の有効性と安全性を検討することを目的とし、2023年1月に患者申出療養として実施が認められた。当院
で9例の患者さんが参加した。2023年11月に小児へ適応が拡大され、2024年11月に小児用製剤が承認された
ため、患者申出療養を終了した。承認までの空白期間(ドラッグ・ラグ)において、患者さんに治療の選択肢を提供す
る橋渡しの役割を果たした。
5