よむ、つかう、まなぶ。
参考資料1 各臨床研究中核病院の活動報告及び特色紹介 (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_62409.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第44回 8/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
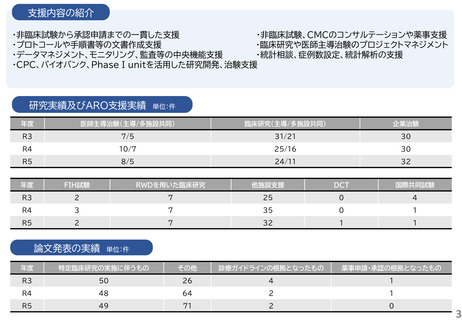
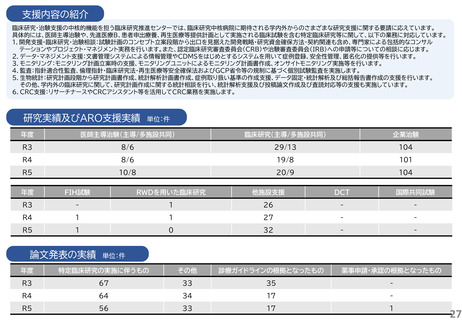
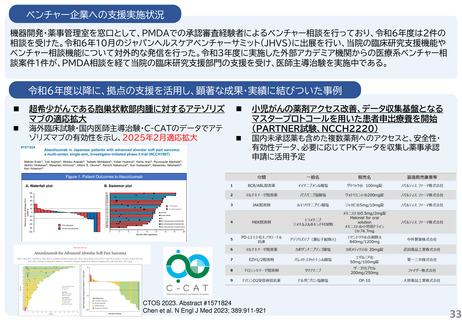
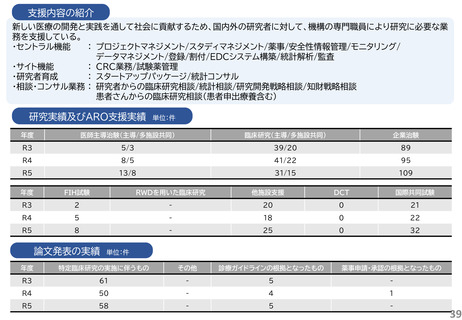
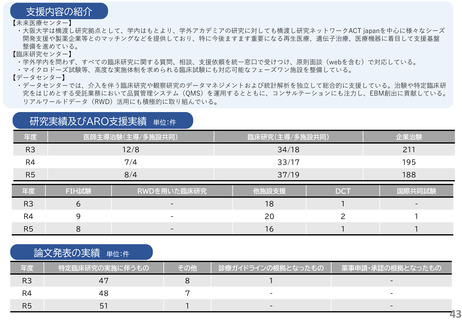
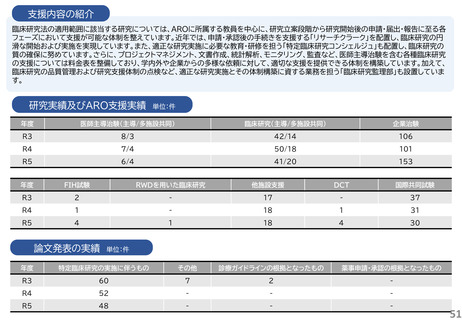
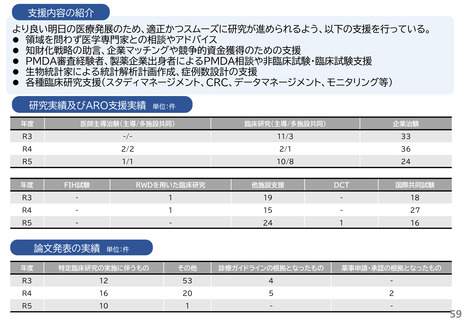
支援内容の紹介
・研究開発戦略相談:相談シーズのステージ(非臨床POC、非臨床安全性試験、臨床研究、医師主導治験等)に応じて、必要な取組を説明している。特に、医師主導治験を目指すシーズについ
ては、治験開始までに取るべきステップ、必要な書類作成についてもアドバイスしている。
・プロトコル作成支援:臨床研究及び医師主導治験のプロトコル作成を支援している。臨床研究の経験豊富な医師、生物統計家、データマネージャー等の専門家がチームとなって議論に参加し、
質の高いプロトコルの作成支援を実施している。
・知的財産戦略相談:相談シーズの新規性・進歩性等の調査、特許申請の代行、国内外での活用と事業化を見据えた戦略的な権利取得・管理についてアドバイスしている。
・調整事務局業務:学内外の医療機関で実施する臨床研究及び医師主導治験に対して、信頼性の高い調整事務局業務を提供している。
・統計解析コンサルティング:生物統計の専門家が、試験デザイン、解析手法及びサンプルサイズの設計等についてアドバイスしている。
・データマネジメント:EDC選択、データベースの設定、データマネジメント計画書、手順書を作成し、臨床研究におけるデータマネジメント業務を効率的に実施している。
・臨床試験コーディネータ業務:臨床研究・治験センター所属のコーディネータを各臨床研究及び医師主導治験に専任でアサインし、医師、被験者及び事務局間の調整業務を実施している。
・モニタリング・監査業務:学内外の医療機関で実施する臨床研究及び医師主導治験に対して、品質の管理と品質の担保する業務を実施している。
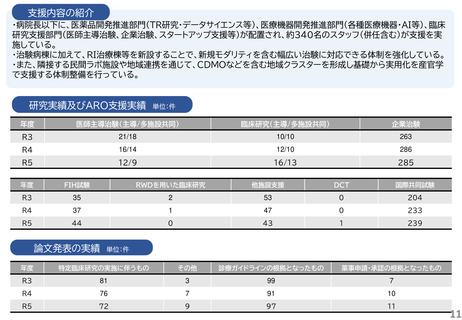
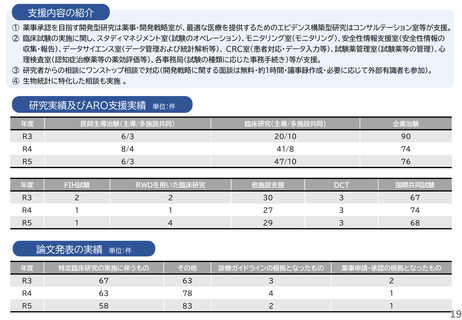
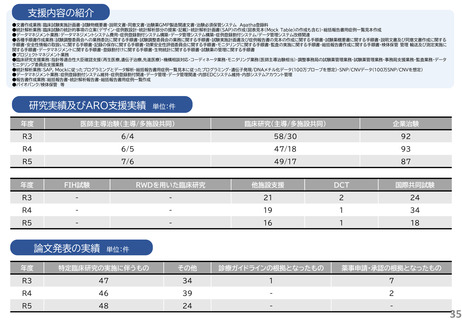
研究実績及びARO支援実績
単位:件
年度
医師主導治験(主導/多施設共同)
臨床研究(主導/多施設共同)
企業治験
R3
4/4
41/15
160
R4
4/3
43/21
153
R5
4/2
40/17
162
年度
FIH試験
RWDを用いた臨床研究
他施設支援
DCT
国際共同試験
R3
-
-
19
2
47
R4
-
4
25
1
34
R5
-
4
25
36
46
論文発表の実績 単位:件
年度
特定臨床研究の実施に伴うもの
その他
診療ガイドラインの根拠となったもの
薬事申請・承認の根拠となったもの
R3
46
-
1
5
R4
49
-
4
6
R5
49
-
2
2
23
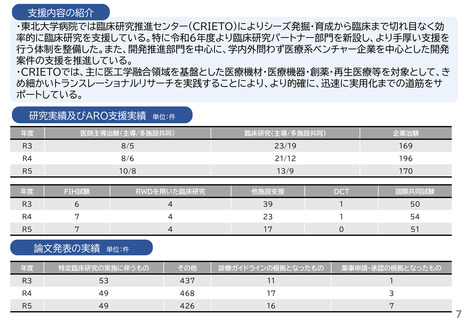
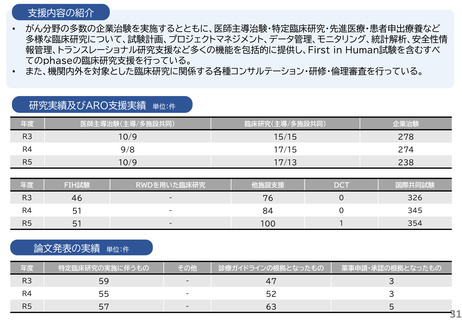
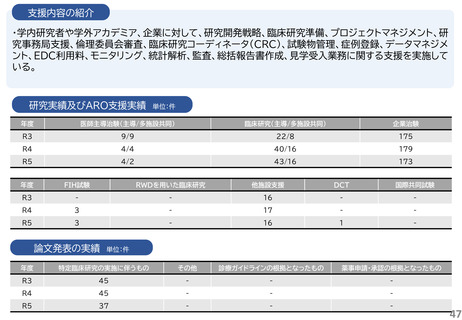
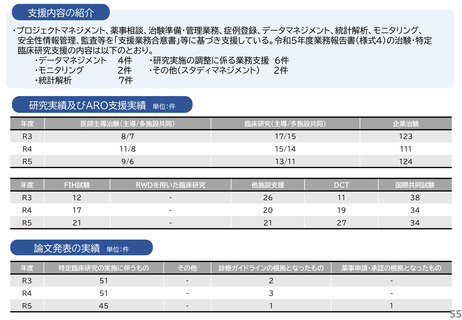
・研究開発戦略相談:相談シーズのステージ(非臨床POC、非臨床安全性試験、臨床研究、医師主導治験等)に応じて、必要な取組を説明している。特に、医師主導治験を目指すシーズについ
ては、治験開始までに取るべきステップ、必要な書類作成についてもアドバイスしている。
・プロトコル作成支援:臨床研究及び医師主導治験のプロトコル作成を支援している。臨床研究の経験豊富な医師、生物統計家、データマネージャー等の専門家がチームとなって議論に参加し、
質の高いプロトコルの作成支援を実施している。
・知的財産戦略相談:相談シーズの新規性・進歩性等の調査、特許申請の代行、国内外での活用と事業化を見据えた戦略的な権利取得・管理についてアドバイスしている。
・調整事務局業務:学内外の医療機関で実施する臨床研究及び医師主導治験に対して、信頼性の高い調整事務局業務を提供している。
・統計解析コンサルティング:生物統計の専門家が、試験デザイン、解析手法及びサンプルサイズの設計等についてアドバイスしている。
・データマネジメント:EDC選択、データベースの設定、データマネジメント計画書、手順書を作成し、臨床研究におけるデータマネジメント業務を効率的に実施している。
・臨床試験コーディネータ業務:臨床研究・治験センター所属のコーディネータを各臨床研究及び医師主導治験に専任でアサインし、医師、被験者及び事務局間の調整業務を実施している。
・モニタリング・監査業務:学内外の医療機関で実施する臨床研究及び医師主導治験に対して、品質の管理と品質の担保する業務を実施している。
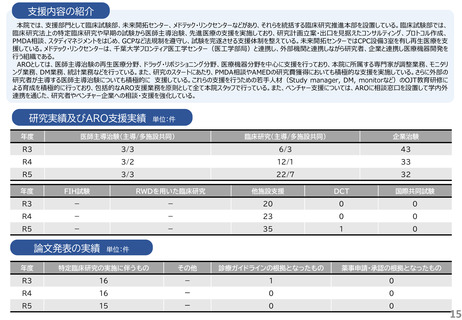
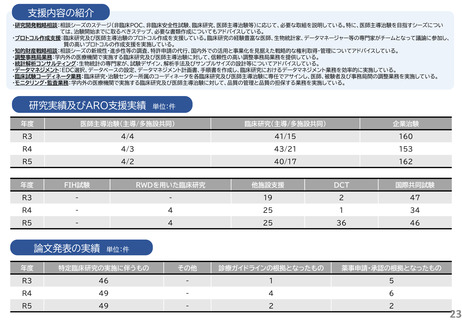
研究実績及びARO支援実績
単位:件
年度
医師主導治験(主導/多施設共同)
臨床研究(主導/多施設共同)
企業治験
R3
4/4
41/15
160
R4
4/3
43/21
153
R5
4/2
40/17
162
年度
FIH試験
RWDを用いた臨床研究
他施設支援
DCT
国際共同試験
R3
-
-
19
2
47
R4
-
4
25
1
34
R5
-
4
25
36
46
論文発表の実績 単位:件
年度
特定臨床研究の実施に伴うもの
その他
診療ガイドラインの根拠となったもの
薬事申請・承認の根拠となったもの
R3
46
-
1
5
R4
49
-
4
6
R5
49
-
2
2
23