提案書18(3402頁~3601頁) (112 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
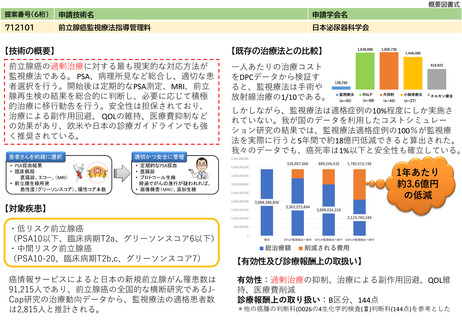
年間対象患者数(人)
7,500
国内年間実施回数(回)
7,500
※患者数及び実施回数の推定根拠等
脳脊髄液リン酸化タウ測定試薬の出荷件数が1社あたり2,500件以上であり、現在3社より測定されていることから、年間
7,500件以上のニーズがあると考えられる。
⑦医療技術の成熟度
・学会等における位置づけ
・難易度(専門性等)
1998年に論文報告が行われて以来、多くの前向き大規模研究によってアルツハイマー病の診断におけるエビデンスが示され
ており、国内外の学会レベルで技術の有用性に関して広知されている。腰椎穿刺は一般的な技術であり、難易度に問題はな
い。イムノアッセイの再現性も技術的に問題ない。
・施設基準
(技術の専門性
等を踏まえ、必
要と考えられる
要件を、項目毎
に記載するこ
と)
施設の要件
(標榜科、手術件数、検査や手術の体
制等)
脳神経内科、精神科、老年内科および脳神経外科などが該当するが、腰椎穿刺自体は基本的な医療技術であり、施設に特別
な要件は必要としない。
人的配置の要件
(医師、看護師等の職種や人数、専門
性や経験年数等)
腰椎穿刺は初期研修レベルで体得する基本的な医療技術であり、特別な人的配置は必要としない。
その他
(遵守すべきガイドライン等その他の
要件)
「認知症に関する脳脊髄液・血液バイオマーカーの適正使用指針」において、"脳脊髄液バイオマーカー検査は、認知症に
関する十分な知識と経験をもつ専門医師が患者を診察し、認知機能状態を把握した上で、検査の目的と有用性を判断して依
頼する必要がある。そのため、バイオマーカー検査に関しては認知症の関連学会の専門医等の医師によって依頼されること
が望ましい。"と記載されている。
⑧安全性
・副作用等のリスクの内容と頻度
副作用として腰椎穿刺後頭痛が挙げられるが、発生頻度は年齢とともに減少することが知られており、本邦における多施設
共同研究における頻度は2.6%と比較的安全であった(参考文献4)。
⑨倫理性・社会的妥当性
(問題点があれば必ず記載)
臨床症状を有し、アルツハイマー病が疑われる患者の診断精度を上げるために実施するものであり、倫理性に問題はなく、
有益性と安全性の観点から社会的妥当性があるといえる。
D
妥当と思われる診療報酬の区分
⑩希望する診療
報酬上の取扱い
点数(1点10円)
1,282
その根拠
既存の検査法として収載されている脳脊髄液リン酸化タウ蛋白(641点)と同等であることが望ましく、アミロイドβ(A
β)42とAβ40の同時測定を基本とするため、641点の倍額に相当する。
区分
関連して減点
や削除が可能と
考えられる医療
技術(③対象疾
患に対して現在
行われている医
療技術を含む)
D
番号
該当なし
技術名
該当なし
具体的な内容
該当なし
減(-)
プラスマイナス
予想影響額(円)
1,313,323,050
・当該技術の費用
診療報酬:上記⑩より1,282点と仮定
年間実施件数:上記⑥より7,500回と推定
12,820円 × 7,500人 = 96,150,000円
予想影響額
その根拠
・節減されるアルツハイマー病薬剤費
アルツハイマー病に対するドネペジル等の1人当たりの年間薬剤費:96,871円/年/人
アルツハイマー病患者の薬物治療の平均実施期間:5年
上記⑤より当該技術によってアルツハイマー病が除外される年間患者数(当該技術対象者の38.8%と仮定):2,910人
96,871円 × 5年 × 2,910人 = 1,409,473,050円
∴予想影響額 =96,150,000円 - 1,409,473,050円 = Δ1,313,323,050円
備考
上記は65歳以上での予想影響額であり、65歳以下の若年性認知症に対する使用を考慮するとさらに影響額(節減)は増大す
ることが予想される。
⑪提案される医療技術において使用される医薬品、医療機
器又は体外診断薬
ルミパルス β-アミロイド1-42、ルミパルス β-アミロイド1-40
(主なものを記載する)
⑫提案される医療技術の海外における公的医療保険(医療
保障)への収載状況
※ 該当する場合、国名、制度名、保険適用上の特徴
(例:年齢制限)等
1)収載されている
1)を選択した場合は、下の欄に詳細を記載。
欧州では体外診断用医薬品として認可・販売されている。ドイツでは臨床的に鑑別困難な認知症に対して保険償還あり。ス
イスでは2019年7月から認知症の診断におけるアルツハイマー病の除外目的に、PET検査の前に限り保険償還あり。米国では
2022年5月に体外診断用医薬品として承認され、今後、抗Aβ抗体がFDAにフル承認されると保険償還される見通しである。
⑬提案される医療技術の先進医療としての取扱い
b. 届出されたが承認されなかった
⑭その他
特になし
⑮当該申請団体以外の関係学会、代表的研究者等
該当なし
3513