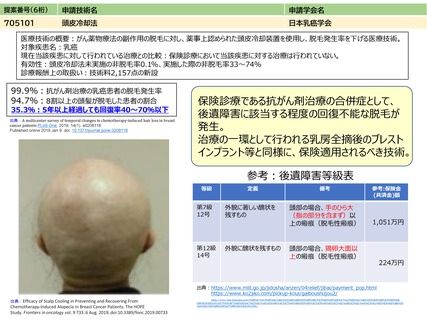
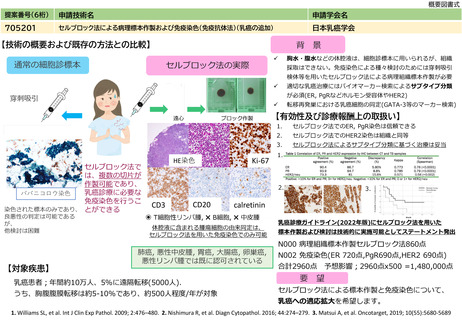
提案書18(3402頁~3601頁) (107 ページ)
出典
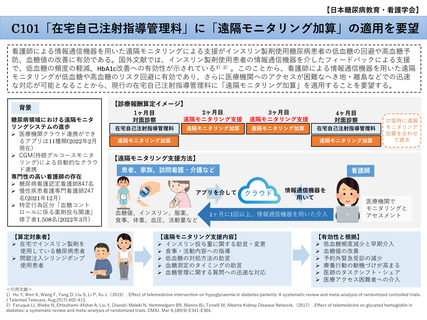
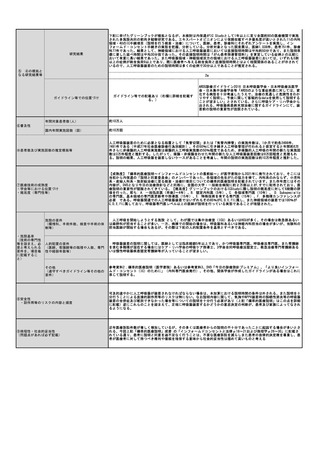
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
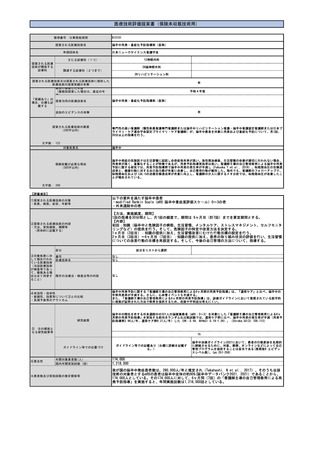
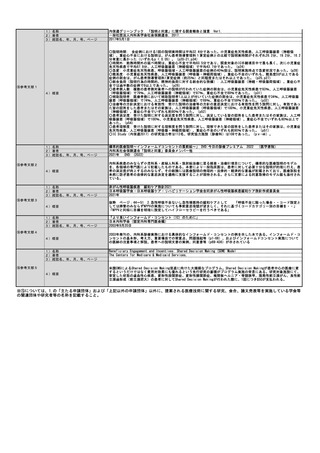
年間対象患者数(人)
64,000人
国内年間実施回数(回)
64,000回
※患者数及び実施回数の推定根拠等
認知症の年間罹患率(60歳以上)は男性1.2%、女性1.66%と報告されいる(Neuroepidemiology, 2008;30:152-60,
Yamada M et al.)。本邦での60歳以上の人口は男性約1,942万人、女性約2,428万人(2022年11月1日現在, 総務省統計局人
口推計)であることから、認知症の年間罹患患者数は男女合計で約63.6万人と推計される。2012年の厚労省報告書では、
MCIをもつ高齢者は約400万人、認知症患者の数は約462万人と報告されている(厚生労働科学研究費補助金認知症対策総合
研究事業「都市部における認知症有病率と認知症の生活機能障害への対応」総合研究報告書)。認知症については、軽度、
中度、重度と進行していくが、同報告書において36.6%が軽度と報告されていることから約169万人が、軽度認知症患者とな
る。認知症の発症は、MCIから認知症へと連続的に起こるものであることから、新規罹患患者は、MCIと軽度認知症が占めて
いるものと考えられる。年間罹患数に占めるMCIと軽度認知症の比が、MCIの患者数と軽度認知症患者数の比と同様であると
仮定した場合、その比は、約400万人:約169万人であるので、年間罹患数約63.6万人のうち、MCIの患者は約44.7万人、軽
度認知症は約18.9万人であると想定される。医療機関受診率は、MCIで約15%、軽度認知症で約50%と見積もられていること
から、MCI患者約6.7万人、軽度認知症患者約9.4万人が医療機関を受診し、認知症診療ガイドラインに従って問診、神経心
理検査、画像検査などが行われると想定される。
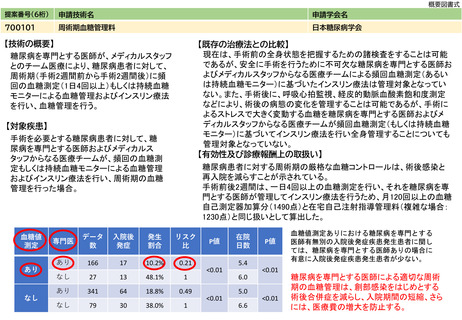
1)認知症又はMCIの病因がADか非ADかの鑑別が困難な患者(症状や年齢が非定型な患者を含む)
医療機関を受診したMCI患者約6.7万人、軽度認知症患者約9.4万人の計16.2万のうち、一般的な認知機能検査とMRIでADと
非ADの鑑別が困難な患者は約10%程度と想定される。本技術の対象患者数は年間約1.6万人となる。ただし、これらの患者
の大部分はDMTの処方判断の対象になると考えられる。
2)DMTの処方を判断する必要がある患者
DMTは、アミロイド病理が確認された早期AD患者に対して処方されることになる。アミロイド病理の確認方法としては、
本技術のほか、脳脊髄液を用いた検査が挙げられるが、いずれもアルツハイマー病が疑われる患者に実施される。レカネマ
ブの第Ⅲ相試験の評価集団に関する学会報告にて、登録後からアミロイドPET検査又は脳脊髄液検査によるアミロイド病理
の確認に至った率は、約44%とされている(The Clinical Trials on Alzheimer's Disease conference 2021, Lynch SY et
al.)。臨床試験実施施設は専門性の高い医療機関であるが、実際のDMTの処方もそのような医療機関で実施されると想定さ
れる。そこで、MCI患者と軽度認知症患者も、同様の割合でアミロイド病理の確認に至ると仮定すると、それぞれ約2.9万人
と約4.2万人、計約7.1万人が本技術又は脳脊髄液検査の対象となりうる。
本技術又は脳脊髄液検査のそれぞれの実施割合について、PET装置の利用可能性及び患者の希望に関する日本の専門家の情
報に基づき、アミロイド病理の確認の対象となった患者のうち90%がアミロイドPET検査、10%が脳脊髄液検査になると想定
されることが報告されている(USC Dornsifeのレポート, Mattke S et al.)。これに従うと、MCI患者2.7万人、軽度認知
症患者約3.7万人の計約6.4万人が本技術の対象となる。
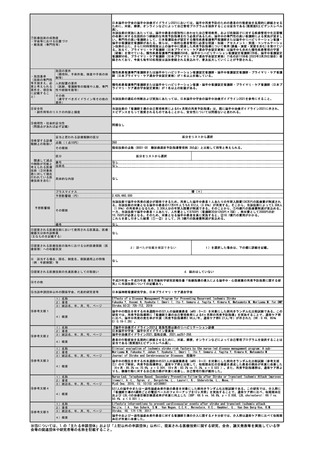
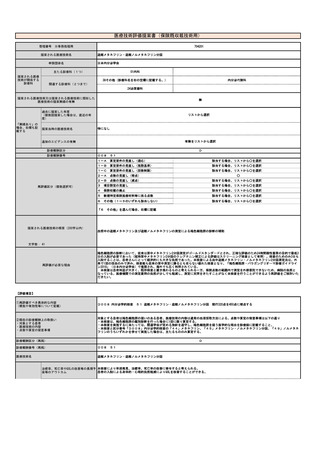
⑦医療技術の成熟度
・学会等における位置づけ
・難易度(専門性等)
既に保険適用となっているPET検査と同等の難易度で、同等の専門性を要する。
・施設基準
(技術の専門性
等を踏まえ、必
要と考えられる
要件を、項目毎
に記載するこ
と)
施設の要件
(標榜科、手術件数、検査や手術の体
制等)
1)施設内でアミロイドPET検査用のPET薬剤を製造するにあたっては、日本核医学会が「院内製造PET薬剤基準」に定める当
該PET薬剤の規格、製法及び品質試験法に従い、かつ「分子イメージング臨床研究に用いるPET薬剤についての基準Ⅰ.製造
基準」に準拠する必要がある。そのために、予め当該合成装置及び当該PET薬剤に対する「診療用PET薬剤製造施設認証」を
取得している必要がある。
2)アミロイドPET撮像にあたっては、日本核医学会が定める「アミロイドイメージング剤を用いた脳PET 撮像の標準的プロ
トコール公開版第6版」を参考に撮像を行う。また、撮像の品質を確保するために、撮像施設は、使用するPET装置に関し
て、日本核医学会が定めるアミロイドイメージング剤を用いた脳PET撮像の「PET撮像施設認証(Ⅰ)」を取得している必要
がある。
人的配置の要件
(医師、看護師等の職種や人数、専門
性や経験年数等)
1)日本核医学会の核医学専門医又はPET核医学認定医の資格を有し、当該PET薬剤又は合成装置の販売等に責任を持つ企業
が実施する読影トレーニングを受け、さらに日本核医学会が実施する当該PET薬剤についての「アミロイドPET読影講習」を
修了した常勤医師が1名以上いること。
2)診断撮影機器ごとに、PET製剤の取扱いに関し、専門の知識及び経験を有する専任の診療放射線技師が1名以上いるこ
と。
その他
(遵守すべきガイドライン等その他の
要件)
1)日本神経学会「認知症疾患診療ガイドライン2017」
2)日本核医学会、日本認知症学会、日本神経学会「アミロイドPETイメージング剤の適正使用ガイドライン改訂第2版」
3)アミロイドPET検査の依頼を行う医師は、認知症関連学会による所定の研修を修了する必要がある。
⑧安全性
・副作用等のリスクの内容と頻度
アミロイドイメージング剤によるポジトロン断層撮影は、国内外の臨床試験において高い忍容性を示している。国内で薬
事承認されている又は薬事承認されている合成装置で合成される18F標識アミロイドイメージング剤(フロルベタピル、フ
ルテメタモル、フロルベタベン)の臨床試験における副作用の発現率はそれぞれ、1.6%、5.5%、8.8%で、重篤な副作用はい
ずれも認められていない。
⑨倫理性・社会的妥当性
(問題点があれば必ず記載)
臨床的に認知症又はMCIがあり、脳内アミロイド病理の確認を必要とする患者に対して実施するものであり、倫理的に問
題はない。
近い将来に発売されることが想定されるDMTの適切な治療効果を得るために、アルツハイマー病を疑われる患者の脳内ア
ミロイドβ蛋白の蓄積を、治療前に非侵襲的に確認することは、社会的妥当性が大いにある。アデュカヌマブ及びレカネマ
ブの臨床試験においては、本技術が患者選択の一つとして用いられていることを踏まえると、本技術が保険適用されなけれ
ば、DMTの治療を受ける患者に不利益を与えることになりかねない。
また、本技術は認知症施策推進総合戦略(新オレンジプラン)でも柱として掲げられている「認知症の容態に応じた適
時・適切な医療・介護等の提供」、「若年性認知症施策の強化」、「認知症の予防法、診断法、治療法、リハビリテーショ
ンモデル、介護モデル等の研究開発及びその成果の普及の推進」に合致しており、社会的妥当性を大いに有する技術であ
る。
E
妥当と思われる診療報酬の区分
⑩希望する診療
報酬上の取扱い
点数(1点10円)
その根拠
関連して減点
や削除が可能と
考えられる医療
技術(③対象疾
患に対して現在
行われている医
療技術を含む)
15,000点
18F標識アミロイドイメージング剤合成費用123,816円(企業の試算に基づく)+ポジトロン断層撮影検査費用26,184円(薬
剤費除く)
区分
その他(右欄に記載する。)
番号
特になし
技術名
特になし
具体的な内容
特になし
3508
特になし