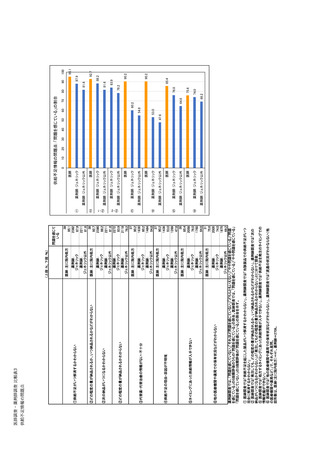
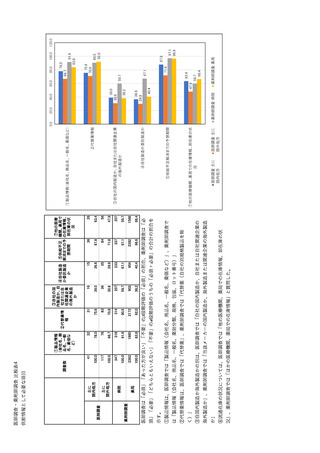
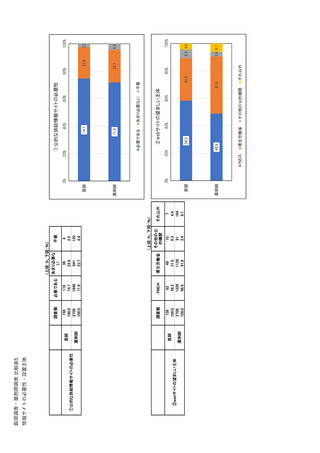
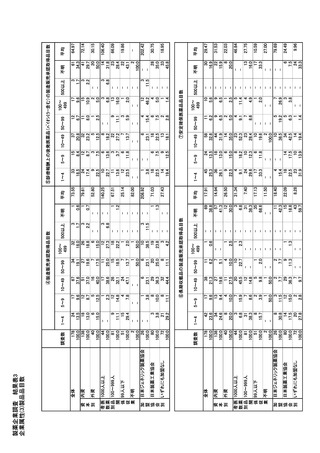
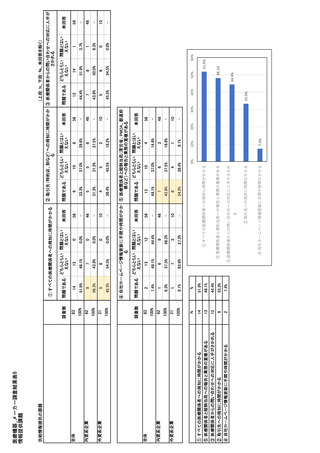
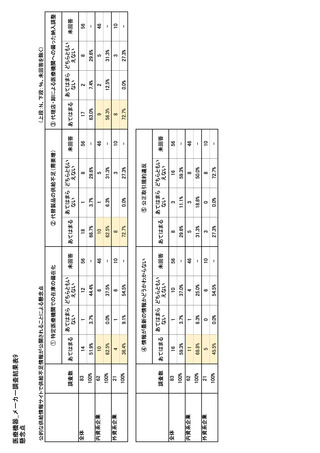
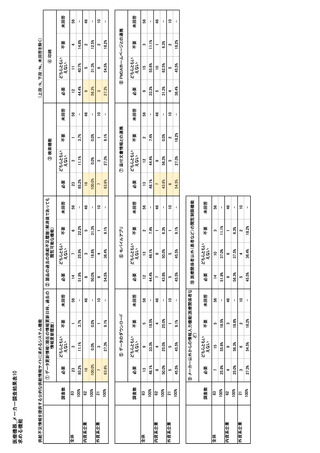
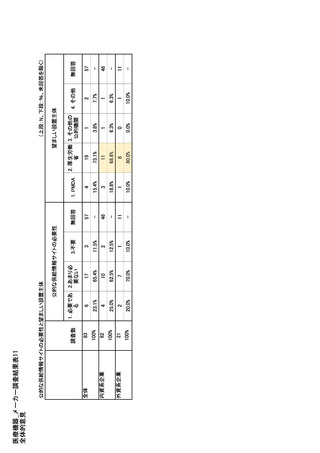
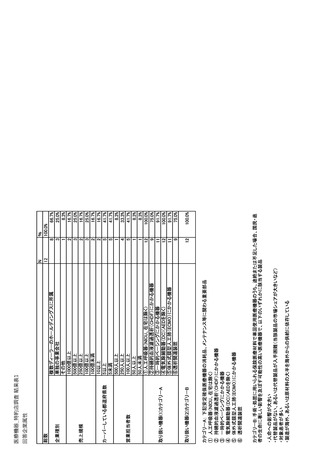
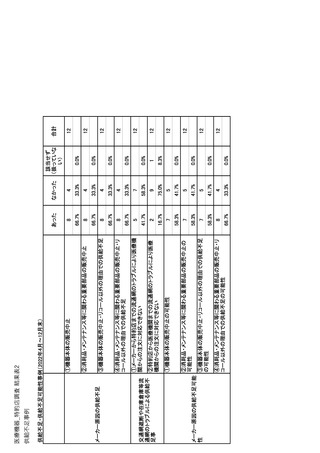
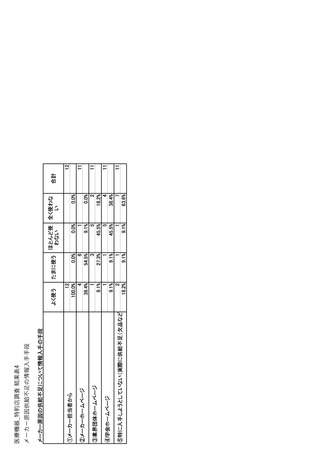
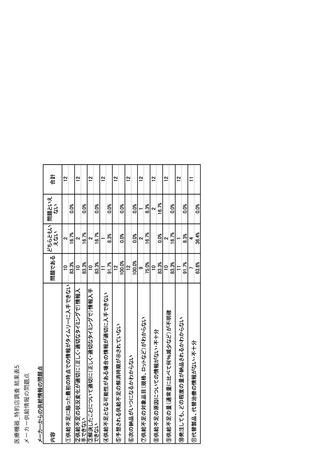
参考資料6 令和4年度厚生労働科学特別研究事業「医療用医薬品・医療機器等の供給情報を医療従 事者等へ適切に提供するための情報システムの構築に向けた研究」(研究代表者:坂巻弘之) (244 ページ)
出典
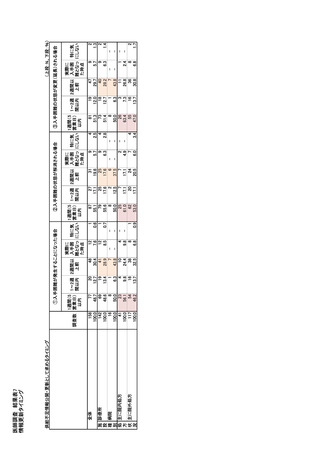
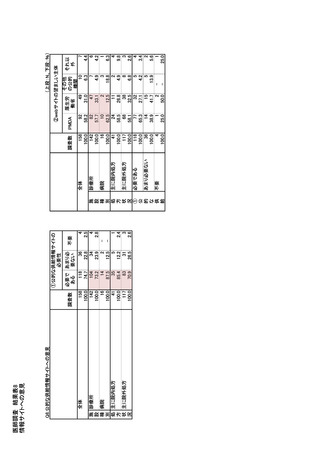
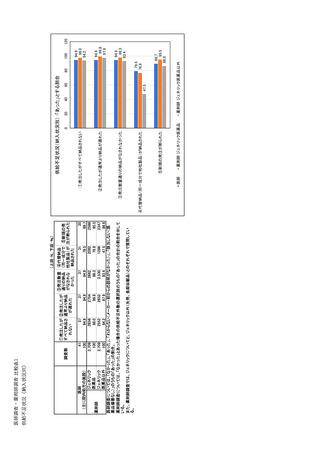
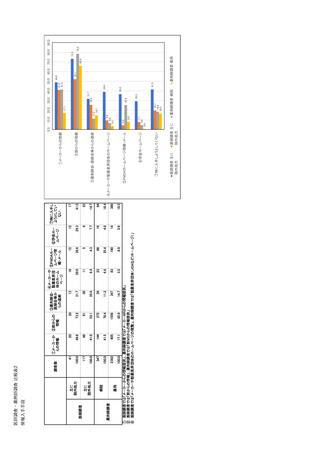
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35103.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議 供給情報ワーキンググループ(第1回 9/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第 5 条第 2 項、第 8 条第 3 項及び第 4 項の勧告の提
及び緩和計画。
供並びに第 8 条第 5 項の措置の調整の方法を規定す
(g)
4.
第 3 項(k)にいう重要医薬品の不足防止・緩和計画を
ること;
補完するため、当機関及び各国の医薬品所轄庁は、
(a)、(b)および(f)に該当する情報を、ウェブポータルの
卸売販売業者及びその他の関係者から、卸売供給チ
専用ウェブページで公開する。
ェーンで発生した物流上の課題に関する情報を要求
第 1 号(a)の目的のために、加盟国、製造販売業者、医薬品
することができるものとする。
のサプライチェーンにおけるその他の関係者及び医療
2.
(a)
(b)
従事者、患者及び消費者の代表者は、必要に応じて
第 10 条 製造販売業者への義務づけ
協議することができる。
1.
公衆衛生上の緊急事態の認定又は第 4 条(3)に基づく
重大事態の認定を受けた後、当機関は
情報を、規則(EC)No 726/2004 の第 57 条 1 項(l)に
重要医薬品リストに含まれる医薬品の製造販売承認取
言及するデータベースに電子投稿の形で提供するも
得者の連絡先リストを作成すること;
のとする。これらの販売承認者は、必要に応じて更新
公衆衛生上の緊急事態又は重大な出来事の期間中、
情報を提供するものとする。
2.
ポイント(a)で言及された単一連絡先のリストを維持す
(c)
(d)
EU で認可された医薬品の販売承認者は、2022 年 9
月 2 日までに、本規則第 9 条 1 項(e)の目的のための
第 7 条の監視を容易にするため、当機関は、重要医
る;
薬品リストに含まれる医薬品の製造販売業者に対し、
重要医薬品リストに掲載された医薬品に関する情報が
第 9 条 2 項(c)の情報の提出を求めることができる。
ESMP で入手できない場合、(a)で言及された単一の窓
本項第 1 号にいう製造販売業者は、第 9 条第 1 項第
口から関連情報を要求し、その情報提出の期限を設定
2 号及び第 3 号に従って確立された監視及び報告の
する;
方法並びにシステムを用いて、第 9 条第 2 項第 2 号
重要医薬品リストに掲載された医薬品に関する情報
にいう単一の連絡先を通じて、要求された情報を、そ
を、第 6 条第 4 項に規定する一連の情報に基づいて、
れぞれ EMA が定めた期限までに提出しなければなら
第 3 条第 6 項に規定する単一の窓口から要求し、そ
ない。これらの販売承認者は、必要に応じて最新情報
の情報が ESMP で入手できない場合には、その情報
を提供するものとする。
3.
の提出期限を設定すること。
第 1 項及び第 2 項の製造販売業者は、要求された情
第 2 項第(c)号の情報には、少なくとも以下の内容が含
報を提供しなかった場合、及び要求された情報を
まれるものとする:
EMA が定める期限までに提供することが遅れた場合、
(a)
医薬品の製造販売承認者の氏名;
その理由を説明するものとする。
(b)
医薬品の名称を記載する;
3.
(c)
(d)
(e)
(f)
4.
第 2 項の販売承認者が、EMA 又は医薬品の国内所
医薬品の完成品及び活性物質の製造拠点が特定され
轄庁の要請により提出した情報に商業上の秘密の性
ていること;
質を有する情報が含まれていることを示す場合、当該
製造販売承認が有効な加盟国及び各加盟国における
情報のうち当該性質を有する関連部分を特定し、当該
医薬品の販売状況;
情報が商業上の秘密の性質を有する理由を説明する
医薬品の実際の不足または潜在的な不足の詳細(実
ものとする。
際のまたは推定される開始日と終了日、疑わしいまた
当機関は、情報の表示ごとに商業上の秘密であるこ
は既知の原因など);
との是非を判断し、当該商業上の秘密情報を不当な
開示から保護するものとします。
医薬品の売上高とシェアデータ;
5.
第 2 項の製造販売業者又は医薬品のサプライチェー
(g)
医薬品の在庫を確保することができる;
(h)
サプライチェーンにおける潜在的な脆弱性、既に納入
ンにおけるその他の関係者が、第 2 項第 2 号に基づ
された数量及び納入予測に関する情報を含む、医薬
き要求される情報に加えて、医薬品の実際の又は潜在
品の供給予測;
的な不足の証拠となる情報を有する場合、当該情報を
(i)
医薬品の需要予測;
直ちに EMA に提供するものとする。
(j)
利用可能な代替医薬品の詳細;
(k)
最低限、最終医薬品及び活性物質の生産・供給能力
項及び第 4 項に従って提供された予防措置又は緩和
及び承認された生産拠点、潜在的な代替生産拠点及
措置に関する勧告に続いて、第 2 項の販売承認者
び医薬品の最低在庫量に関する情報を含む不足防止
は、以下のことを行う:
6.
242
第 7 条のモニタリングの結果の報告及び第 8 条第 3