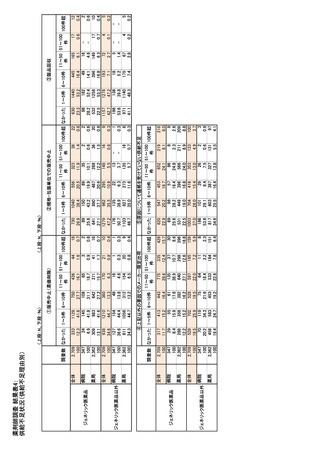
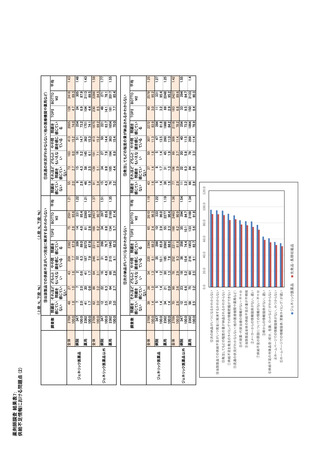
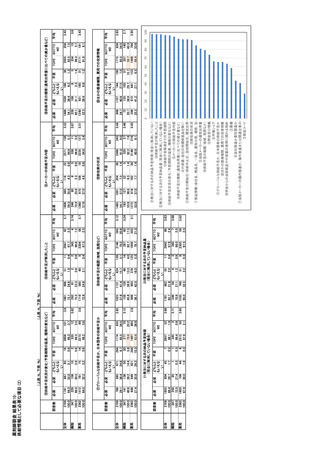
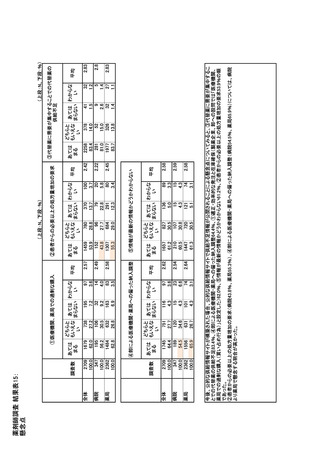
参考資料6 令和4年度厚生労働科学特別研究事業「医療用医薬品・医療機器等の供給情報を医療従 事者等へ適切に提供するための情報システムの構築に向けた研究」(研究代表者:坂巻弘之) (159 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35103.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議 供給情報ワーキンググループ(第1回 9/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
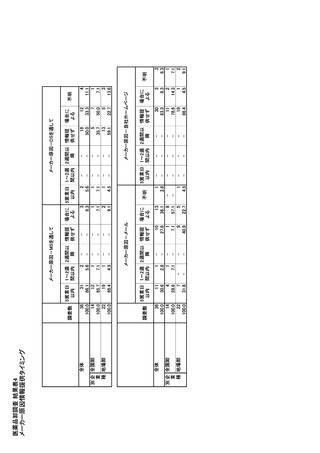
供給チーム(DHSC Medicine supply team)がおかれ、
な有効成分/製品のリストの評価・監視が実施されて
医療用医薬品に関係する各組織と連携し、供給不足
いる。製薬企業は、重要な有効成分/製品のリストに
を防ぎ、供給不足が発生した場合に、リスクアセスメ
含まれる完成品の在庫、生産及び販売量を定期的
ントを行い、患者へのリスクを最小限に抑えるための
に諮問委員会に提出する。BfArM は、報告された供
支援を行う。
給不足情報を PharmNet.Bund ホームページにて一
般に公開している。
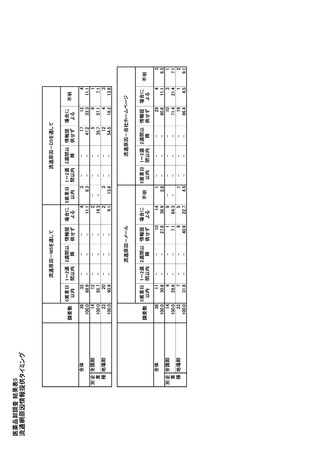
G.EU
欧州委員会は、2023 年 4 月、医薬品のアクセス、イ
E.フランス
ノベーション推進と承認期間の短縮、安定供給、環
公衆衛生法(Code de la santé publique)に基づき、
境負荷の軽減などの目的のため、EU の医薬品関連
企業は、医薬品・健康食品安全庁(Agence nationale
法の改正を提案した。医薬品供給不足対策として、
de sécurité du médicament et des produits de santé;
EMA により医薬品不足の監視と緩和が行われる。ま
ANSM)に供給不足情報の提供が義務付けられてい
た、製薬企業は、医薬品の不足をより迅速に報告し、
る。フランス国内で代替薬が存在せず、公衆衛生上
不足防止計画を策定しなければならいこととなった。
のリスクにつながる可能性のある医薬品について「主
また、EU の重要医薬品リストが策定されることになっ
要な治療的関心のある薬物(médicaments d'intérêt
た。
thérapeutique majeur;MITM)」が規定されており、安
2023 年 5 月には「欧州医薬品庁が業界向けの、医薬
全在庫の確保が義務付けられる。また、供給不足管
品供給防止・影響の最小化のためのガイダンス」が公
理計画が毎年、製薬企業から ANSM に提出される。
表されている。
供給不足管理計画には、供給不足につながるリスク
の評価、供給不足時の対応の在庫管理計画、供給
F.健康危険情報
不足の際の措置が含まれる。
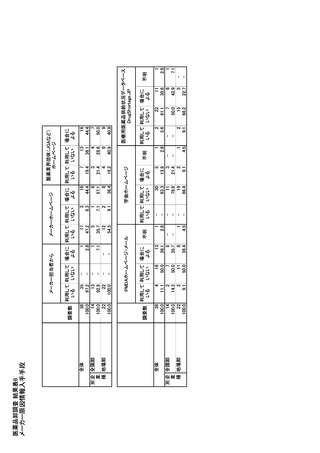
該当しない。
F.英国
G.研究発表
製品ライセンスの保有者(MHA)は、英国内の患
者のニーズが満たされるように、薬局および製品を供
1.論文発表
給する権限を有する者に対して、証明書に関連する
未実施。
製品の適切かつ継続的な供給を確保する一般的な
2.学会発表
義務を負う(「ヒト医薬品規則 2012 年第 118 条」
未実施
regulation 118, Human Medicines Regulations 2012)。
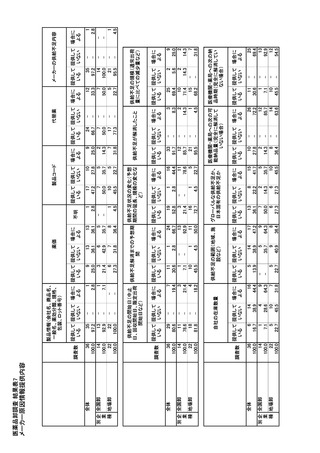
H.知的財産権の出願・登録状況
英国保健省 DHSC は、2019 年 1 月、英国製薬産
業協会 ABPI および英国ジェネリック製薬業協会
(予定を含む。)
BGMA と合意し、医薬品不足を報告するための指針
1.特許取得
を公表した。製薬企業は、この指針に基づき、医薬品
予定なし。
不足を DHSC に報告するとともに、供給の問題を管
2.実用新案登録
理し、患者への潜在的な影響を軽減するための措置
予定なし。
3.その他
をとる必要がある。また、供給情報提供しなかった場
予定なし。
合のペナルティとしは、罰金の支払い義務が生ずる。
保健社会福祉省(DHSC のもとに、DHSC 医薬品
157