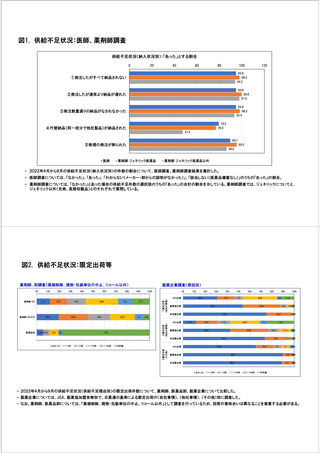
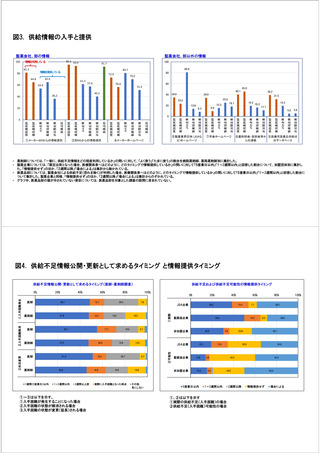
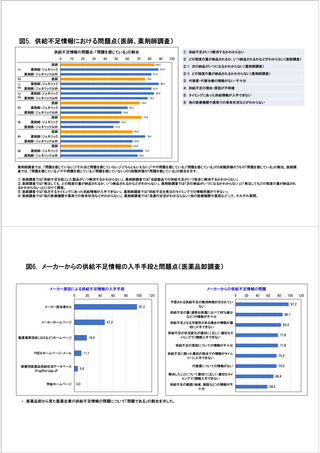
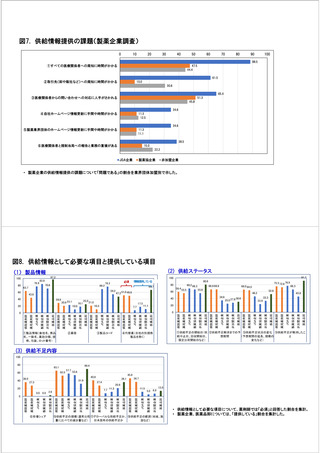
参考資料6 令和4年度厚生労働科学特別研究事業「医療用医薬品・医療機器等の供給情報を医療従 事者等へ適切に提供するための情報システムの構築に向けた研究」(研究代表者:坂巻弘之) (219 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35103.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議 供給情報ワーキンググループ(第1回 9/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
Transparence)、医療経済学委員会(CEESP:
(2) 医療用品経済委員会(CEPS)による価格決定
Commission d’ Évaluation Économique et de Santé
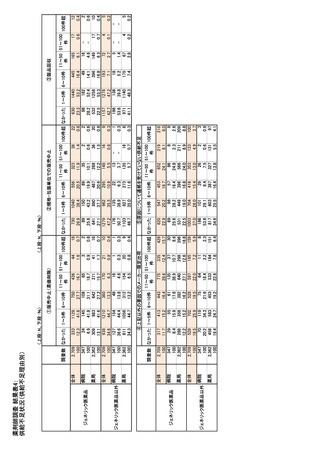
①医療上の有用性の改善(ASMR)レベルと価格
の原則 22)
Publique)、医療材料・医療技術評価委員会
(CNEDiMTS:Commission Nationale d'Évaluation
製薬企業は他国から海外参照を受ける関係で表
des Dispositifs Médicaux et des Technologies de
面(リスト)上だけでも高い価格を望むため、医療保
Santé)などの専門委員会を有している。
険支出全国目標(ONDAM)などを達成するために
医療用品経済委員会(CEPS)が重視するネット価格
【透明性委員会(CT)19)】
との差額は個別内容非開示の値引き契約でカバー
医薬品市場流通許可(AMM)を得た医薬品の医
される。
療上の有用性(SMR)や既存医薬品に対する医療
また、医療上の有用性(SMR)評価による償還率
上の有用性の改善(ASMR:Amélioration Service
を一本化しようという試みとして、最も償還率の低い
Médical Rendu)を評価する。
ものについては、削減を考えていたが、まだ実現し
医療上の有用性(SMR)/医療上の有用性の改善
ていない。近年、ヒアルロン酸ナトリウム、関節リウマ
(ASMR)は適応・患者集団ごとに付与され、医療上
チ治療薬と、同毒療法(ホメオパシー)医薬品など、
の有用性(SMR)が不十分の場合、医療上の有用
償還率が低いものから、償還対象外となっている。
性の改善(ASMR)は付与されない。医療上の有用
性の改善(ASMR)評価の基準は法と政令で定めら
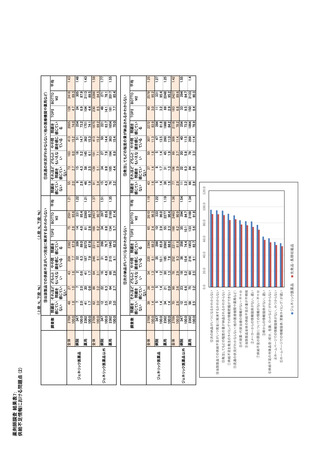
②欧州価格保証 1),21)
れておらず、ドミニク・ポルトン報告書や 8th CSIS で
2020 年枠組合意 9 条による、欧州参照国の最低
その明確化が求められていたが、2018 年 9 月に透
価格を下回らないレベルを 5 年間保証する取り決
明性委員会(CT)はこれまでの内部の評価方針を
め。医療経済学委員会(CEESP)で医療経済評価
明示し、更新している。
が行われることが条件で、その結果により欧州価格
医療上の有用性の改善(ASMR)評価要素
20
保証の適用を否定された例がこれまでに数件ある。
– 医療上の改善度の証拠の質
保障される価格はリストに掲載される表面価格であ
– 比較対象薬と比べた効果、QOL、忍容性の改
り、値引き契約を含む個別協約の締結が必須とな
善度合い
る。適応拡大があった場合、値引き契約の内容を患
– 改善された効果、QOL、忍容性の患者や医師
者数に基づいて再設定し、表面価格の保障期間は
1 年短縮される。欧州価格保証品については、早期
から見た意味
– 医療上の必要性(アンメットニーズを効果的に
リスト収載(社会保障法典(CSS) L. 162-17-6)の対
満たすか)
象とすることも可能であり、これを希望する場合、販
売数量、一日薬価、参照国の価格などの前提条件
【医療経済学委員会(CEESP)21)】
を元にした供託価格(dépôt de prix)の扱いで掲載
経済公衆衛生評価委員会(CEESP)は、医療政
し、前提条件が固まった段階で差額を返還する契
策における科学的有効性、経済性、公衆衛生的評
約を結ぶことで早期掲載が可能となる。この場合、
価、倫理性などに意見を出す委員会である。当初
実際の使用状況に関する調査報告が求められる。
は市販後の再評価において医療経済的側面、倫
理・社会的側面、障害の軽減など社会への貢献度
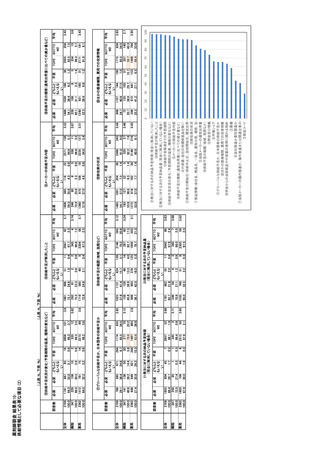
➂外国価格参照 1)、23)
を評価していたが、2013 年 10 月からは後述の基準
欧州参照国はイギリス、ドイツ、イタリア、スペイン
を満たした新薬に対しても医療経済評価を行い、価
である。価格参照は価格決定時のみでなく、欧州価
格決定の一要素になっている。
格保証適用品は参照国の販売数量や価格を逐次
217