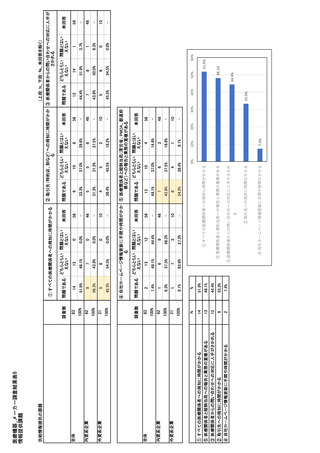
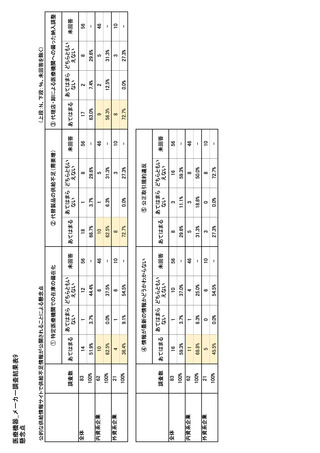
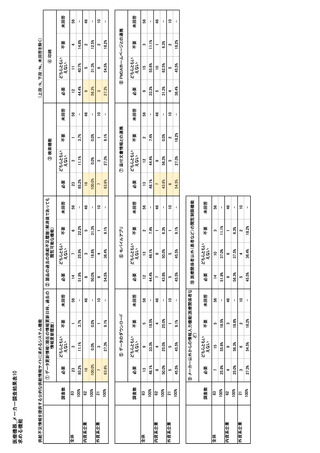
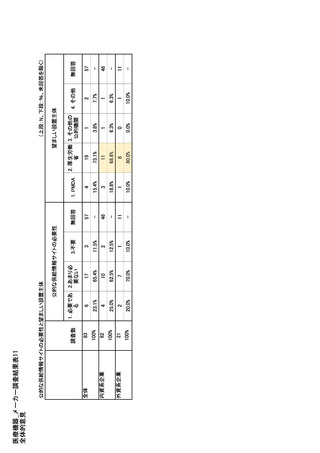
参考資料6 令和4年度厚生労働科学特別研究事業「医療用医薬品・医療機器等の供給情報を医療従 事者等へ適切に提供するための情報システムの構築に向けた研究」(研究代表者:坂巻弘之) (197 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35103.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議 供給情報ワーキンググループ(第1回 9/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
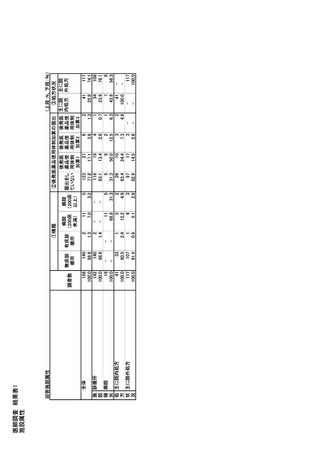
態、医療製品登録制度(ARTG)番号
- 供給不足の理由
いが、強く推奨されている。
- 供給停止の推定期間
④患者への影響が少ないと評価した場合:
- 状況(現在、予想される、解決済み、または中止
メーカーから関連する医療提供者のみへの連絡
- 患者への影響度
が求められる。なお、医療製品管理局(TGA)の
- 必要に応じて、その医薬品に関する追加の供
Web サイトでの供給不足に関する情報の公開は義
給詳細
務ではないが、強く推奨される。
- 必要に応じて、代替医薬品または代替治療法
に関する情報
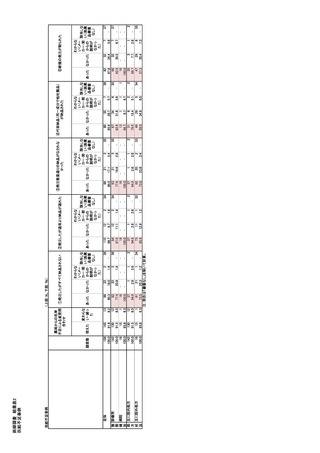
このように患者への影響の大きさに応じて、メーカ
- 医療製品管理局(TGA)の管理措置
ーの伝達内容や範囲が段階的に異なる。なお、中
程度及び重大な患者への影響のある不足の場合、
② 対象医薬品(必須薬など)25)、26)
メーカーは適切な情報の共有のため、対応方針や
報告対象の医薬品は以下の通り。ただし、その他
対応状況といったより詳細な情報を求められることも
の一般用医薬品の入手可能性に関する情報、また
ある。
は通常スペシャルアクセススキームや Authorized
医療製品管理局(TGA)はその後、専門医院や
Prescriber スキームを通じて入手される医薬品に関
その他の関係者に直接連絡して、供給不足を通知
する情報は含まれない 25)。なお、Authorized
し、公表された情報を注意喚起する。医療専門家
Prescriber スキームとは、認定をもつ医療従事者が、
や卸売業者だけでなく、顧客に合わせた通知が必
特定の病状を持つ患者に、オーストラリアの治療製
要になる場合もある。そして医療製品管理局(TGA)
品登録簿 (ARTG)に含まれていない治療製品(医薬
は、メーカー、関係学会、オーストラリア病院薬剤師
品、医療機器、生物製剤など)を供給できる制度で
会、オーストラリア薬学会、オーストラリア薬局組合
ある 26)。
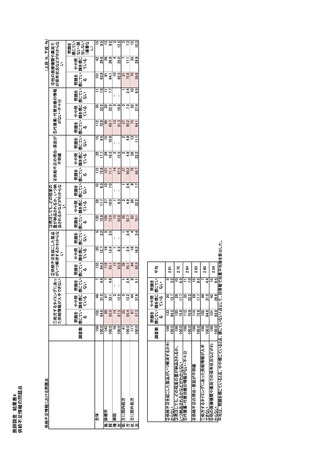
そして、法第 19 条 A(医薬品不足に対処する為の
・登録第 4 類(処方箋)医薬品
医薬品の輸入及び供給に関するセクション 19A
・登録別表 8(規制薬物)医薬品
条)の申請予定者とそれぞれ連携して対応する。医
・治療用医薬品(報告対象医薬品)の決定に含ま
療製品管理局(TGA)は必要に応じて、適切な代替
れる一般用医薬品
海外製品を特定し、スペシャルアクセススキームを
・法第 31 条 EH(1)(b)(ii)に基づく文書で
通じて海外からの代替品調達を促進する。
定められた一般用医薬品
また、医療製品管理局(TGA)はメーカーがステ
ークホルダーと供給不足に関するタイムリーな情報
➂ 企業からの報告の流れ 25)
企業は、医薬品の供給不足が予想される際、影
共有ができるよう調整する。そして、患者への影響
響を受ける患者数及び代替品の有無で、影響を評
が大きい場合には、供給不足に関わる情報を医薬
価した報告書を医療製品管理局(TGA)に提出す
品供給不足報告データベース(Medicine shortage
る。患者への影響が重大な場合には 2 営業日以内
reports database)でできるだけ早く公開する。
に、その他の場合は 10 営業日以内に提出した報
告書を提出する。
(3)医薬品供給不足報告データベース
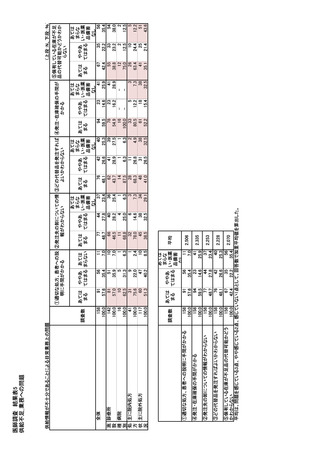
①概要(表示内容)25)
- 企業名および連絡先
医療製品管理局(TGA)は提出された報告書を
審査し、影響度に応じてクイックタッチレビューを実
- 製品の有効成分および商品名、力価、投与
施する。該当医薬品が The Medicines Watch List に
195