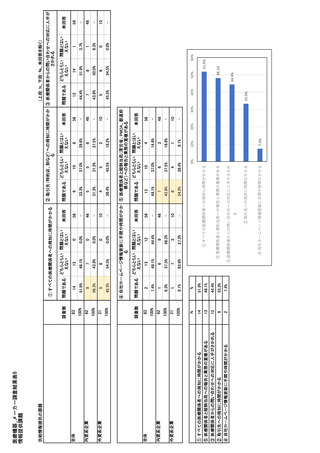
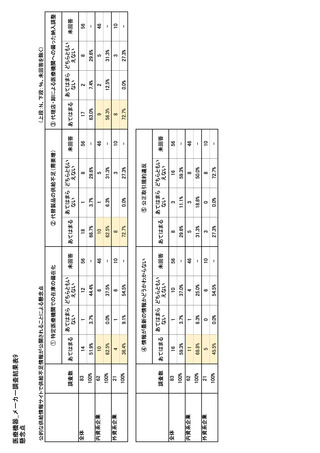
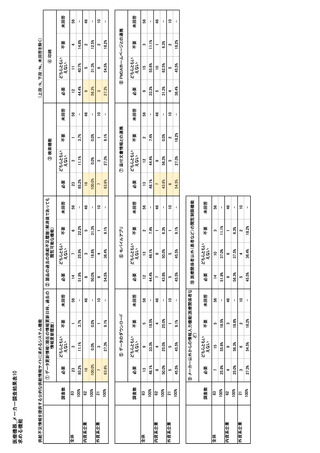
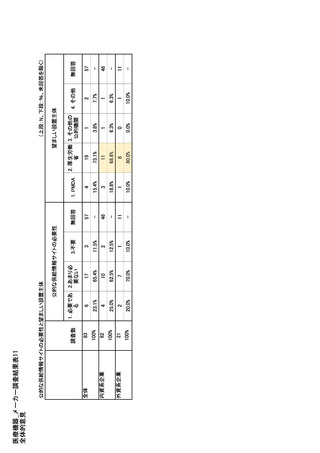
参考資料6 令和4年度厚生労働科学特別研究事業「医療用医薬品・医療機器等の供給情報を医療従 事者等へ適切に提供するための情報システムの構築に向けた研究」(研究代表者:坂巻弘之) (158 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35103.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議 供給情報ワーキンググループ(第1回 9/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
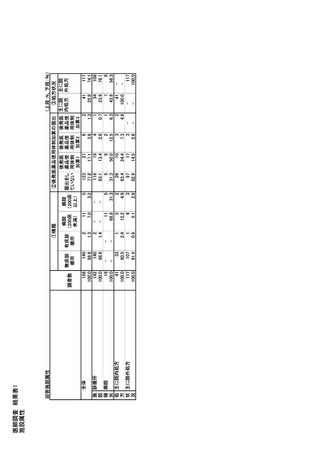
関する「医薬品不足の通知と伝達のためのプロトコル」
担当部署は、生物製剤評価研究センター(CBER)で
を策定している。その他、。カナダ保健省はメーカー
あり、CDER に所属する Drug Shortage Staff(DSS)は、
と協力し、必要に応じて代替サプライヤー、製造プロ
医薬品不足の防止と緩和に関連するすべての活動
セスの変更、製造場所の変更などを検討する。
の調整を担当する。
なお、2023 年 4 月、FDAは、企業からの報告ガイドラ
C.オーストラリア
インの改訂版(ドラフト版)を公開した。
医薬品供給不足及び製造中止の場合には、
Notifying FDA of a Discontinuance or Interruption in
Therapeutic Goods Act 1989 により 医療製品管理局
Manufacturing of Finished Products or Active
(TGA)への通知が義務付けられている。
Pharmaceutical Ingredients Under Section 506C of the
患者に重大な影響を与える医薬品を特定した The
FD&C
Medicines Watch List があり、このリストを含めて患者
Act-Guidance
for
Industry
(https://www.fda.gov/regulatory-information/search-
への影響度を分析され、患者への影響の大きさに応
fda-guidance-documents/notifying-fda-
じて、メーカーの伝達内容や範囲が段階的に異なる。
discontinuance-or-interruption-manufacturing-
The Medicines Watch List は医療製品管理局(TGA)
finished-products-or-active)
によって毎年見直される。
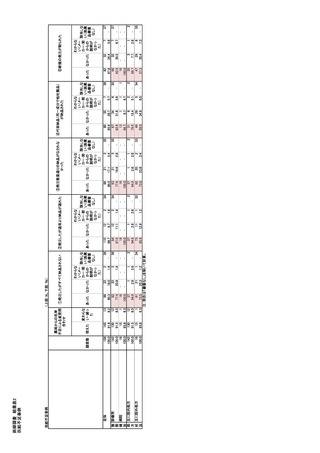
医薬品不足に対するプロトコールが製薬企業の業界
B.カナダ
団体、流通団体、薬剤師・薬局ならびに病院薬剤師
食品・医薬品規制法 Food and Drug Regulations
関係団体、および政府の共同発議として作成されて
(FDR)により、供給不安及び販売中止の際には、供
いる。プロトコールでは、供給不足について定義し、
給不足及び製造中止に関しては、第三者機関サイト
潜在的な供給不足の特定と管理原則を示し、TGA に
である Drug Shortages Canada を通じて報告することを
対し、すべての不足の報告を義務化することにより、
企業に義務付けている。なお、供給不足が予想され
る場合もしくは 実際の供給不足の状況に応じて、情
オーストラリアにおける医薬品不足の管理とコミュニケ
報提供及び連携の仕方を 3 階層(Tiers)で規定して
いる。
ーションを改善することを意図している。企業から報
Tier1:供給不足が予想される場合
告される影響度に関するレポートは TGA により評価
Tier2:供給不足の場合
される。影響評価は、関連する専門家(医師や薬剤
Tier3:実際の医薬品供給不足の場合(カナダ国内
師など)によりなされ、在庫評価や代替治療の特定と
での代替薬がない場合)
通知を行う。不足が医療上重要な影響を与えると判
カナダの医薬品供給不足・製造中止報告義務サイ
断された場合、企業は関係者への情報提供と不足解
トは、カナダ保健省との契約に基づき、第三者機関で
消のための管理戦略を実施することが求められる。
あるベル・カナダが運営している。供給不足情報は、
Drug Shortages Canada に掲載される。
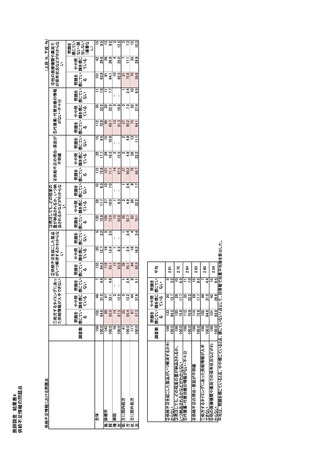
D.ドイツ
医薬品不足に関しては、業界団体、連邦政府、州
薬事法(Arzneimittelgesetz:AMG)セクション 52b
政府、地域政府、医療専門家団体の代表者からなる
「医薬品の供給」により、医薬品事業者と卸売業者に
マルチステークホルダー・ステアリング・コミッティ
継続的な供給が義務付けられている。さらに、連邦医
(MSSC)が組織されており、医薬品不足に対処する
薬品医療機器研究所(Bundesinstitut fürArzneimittel
ためのツールや戦略を明らかにする「MSSC マルチス
und Medizinprodukte :BfArM)内に諮問委員会を設
テークホルダーツールキット」、医薬品不足を予期し、
置し、医薬品の供給状況を監視・評価することを義務
あるいはそれに対応するための情報の通知と伝達に
付けている。諮問委員会は、医療提供において重要
156