参考資料6 令和4年度厚生労働科学特別研究事業「医療用医薬品・医療機器等の供給情報を医療従 事者等へ適切に提供するための情報システムの構築に向けた研究」(研究代表者:坂巻弘之) (226 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35103.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議 供給情報ワーキンググループ(第1回 9/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
供給不足とは、調剤薬局又は公衆衛生法典
(2) 供給不足管理計画 32)
供給不足管理計画は毎年製薬企業から ANSM
(CSP)L.5126-1 法に規定する薬局が、公衆衛生法
に提出される。なお、供給不足管理計画に規定す
典(CSP)R.5124-2 に規定する企業(メーカー、卸
る項目は以下の通りである。
等)2 社に要請したが、72 時間以内に医薬品を調
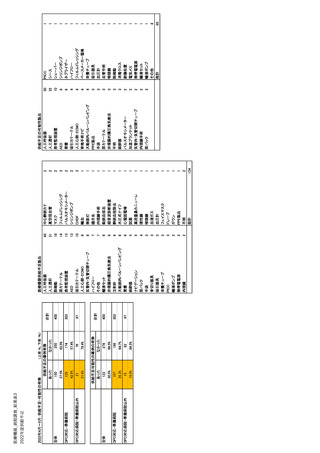
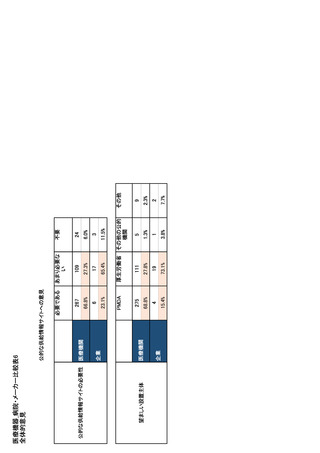
① 基礎情報
剤できないことを指す。メーカーは、治療上重要な
・医薬品名称(一般名、力価、剤形、CIP コード、
医薬品の供給不足もしくは供給不足が予測される
ATC コード)
場合には、供給不足の発生時期、入手可能な代替
品、入手方法等を ANSM に報告することを公衆衛
・企業名
生法により義務付けられている 29)。
・企業住所
・連絡先(電話番号・メールアドレス)
また、安全在庫についても規定されている。安全
・代替品もしくは代替療法
在庫とは、過去 12 ヶ月間の国内における当該医薬
・供給不足期間
品の販売量に基づき算出された、フランス国内での
・患者への影響度
流通が可能な完成品の単位数で、医療上の必要性
・フランス国内の販売チャネル(市・病院・流通チ
に応じた量を保管することを意味する。特段の定め
ャネルごとの月平均販売量とシェア)
のない医薬品は 1 週間分、厚生大臣が定める公衆
・国外での代替品の有無
衛生政策に貢献する医薬品は 1 ヶ月分、公衆衛生
法典(CSP)L. 5111-4 条に規定される治療上重要な
② 供給不足につながるリスクの評価
医薬品は最低 2 ヶ月分を確保することが義務付け
・原薬におけるリスクの特定、分析、評価及び製
造所
られている。安全在庫の基準値は、製薬企業からの
・製剤におけるリスクの特定、分析、評価及び製
申請で状況に応じて引下げも可能であるが、供給
造所、包装施設
不足の実績や必要に応じて医薬品安全庁長官の
・製品の流通過程におけるリスクの特定、分析、
判断で引き上げる事もある。なお、最低安全在庫が
2 ヶ月未満の製品リスト及び 4 ヶ月以上の製品リスト
評価及び倉庫、卸等流通に関わる拠点
は医薬品・健康食品安全庁の HP で確認することが
・その他のリスクの特定、分析、評価(市場要素、
できる 30。
季節性等)
(1)供給状況の管理指針 31)
フランスでは、公衆衛生法に基づき、治療の中断
➂ 供給不足時の対応の在庫管理計画
が患者の生命予後を危うくする可能性のある医薬
・原薬他ソースの情報(承認状況含む)
品または医薬品群を Major Therapeutic Interest
・他の製造施設の有無と拠点
(MITM)を定義している。Major Therapeutic Interest
・その他防止策、計画
・国内市場の安全在庫レベル及び保管場所
では、供給不足管理計画(PGP)が義務付けられて
④ 供給不足の際の措置
おり、この計画はメーカーと販売承認者が、当該医
・割り当て(量的、質的)
薬品の供給不安リスクや管理手段等をレビューし、
・流通経路の制限、変更
監視するために活用される。また、Major
・在庫の再活用(他の欧州連合(EU)または非
Therapeutic Interest の供給状況は医薬品・健康食
EU 市場向けだった在庫をフランス市場で使用す
品安全庁の HP で確認することができる。
る可能性(供給/輸入))
・他有効成分や剤形への切り替えの可能
224