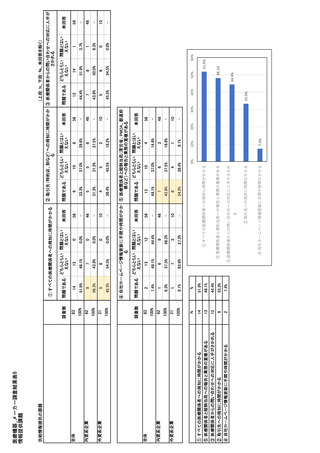
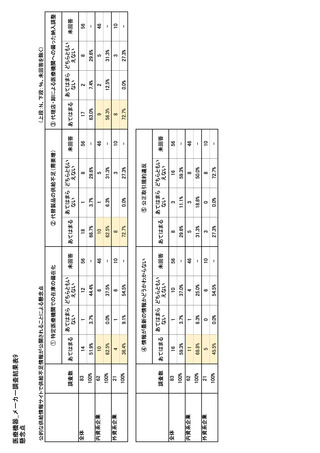
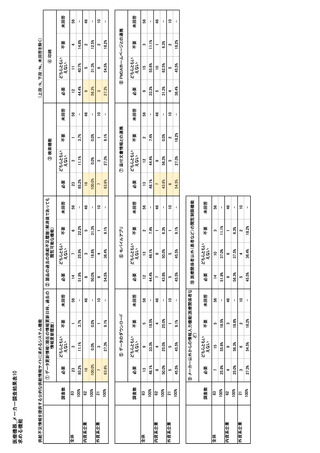
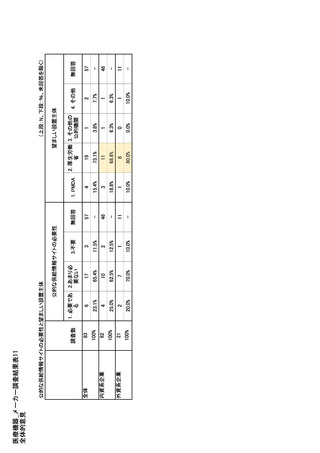
参考資料6 令和4年度厚生労働科学特別研究事業「医療用医薬品・医療機器等の供給情報を医療従 事者等へ適切に提供するための情報システムの構築に向けた研究」(研究代表者:坂巻弘之) (243 ページ)
出典
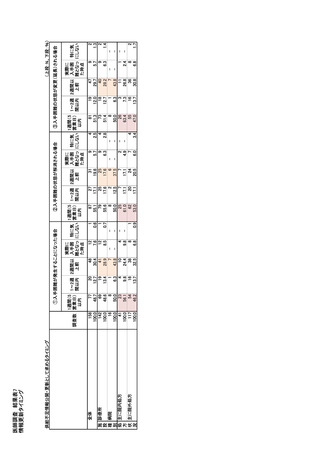
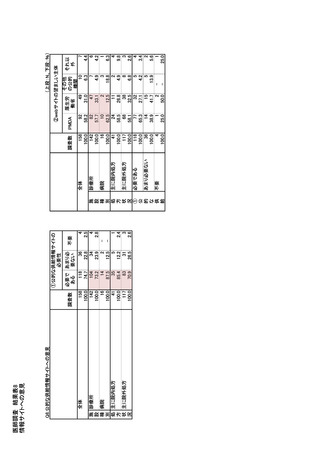
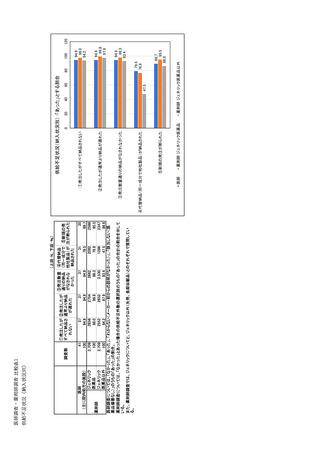
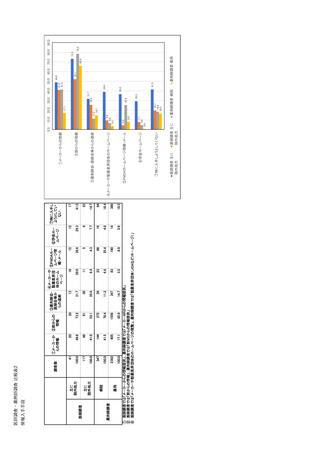
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35103.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議 供給情報ワーキンググループ(第1回 9/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
じて、医薬品のサプライチェーンの他の関係者にも
提供されることができるものとする。
第 7 条 重要医薬品リストに掲載された医薬品の不足をモニ
3.
薬品の実際の又は潜在的な不足を防止又は緩和する
公衆衛生上の緊急事態の認識又は第 4 条(3)に基
ために、欧州委員会、加盟国、販売承認者及び医療
づく重大な出来事の認識の後、MSSG は、重要医薬
従事者及び患者の代表を含むその他の団体が取り得
品リストに含まれる医薬品の供給及び需要を監視し、
る措置に関する勧告を行うことができる。
これらの医薬品の実際の不足又は潜在的不足を特
加盟国は、第 1 号にいう措置に関する勧告を提供する
定することを目的とするものとする。MSSG は、ESMP
よう MSSG に要請することができる。
が完全に機能した時点で、重要医薬品リスト及び第
第 2 号の目的のため、MSSG は、関連する場合、保
10 条及び第 11 条に従って提供され、ESMP を通じ
健委員会及び公衆衛生上の緊急事態の場合には、
て利用可能な情報及びデータを用いて当該モニタリ
連合法に従って設置された公衆衛生上の緊急事態
ングを実施するものとする。
に関する他の関連諮問委員会と連絡を取るものとす
本条第 1 項にいう監視の目的のため、関連する場
る。
合、MSSG は、決定第 1082/2013/EU 号(「HSC」)の
4.
盟国の要請により、公衆衛生上の緊急事態または重大
生緊急事態の場合、連合法に従い設立された公衆
な出来事によって生じる医薬品の実際または潜在的な
衛生緊急事態に関する他の関連諮問委員会及び
不足に対処するための備えを確保するために欧州委
ECDC と連絡を取るものとする。(以下略)
員会、加盟国、販売承認者、医療従事者の代表およ
びその他の団体が取り得る措置に関する勧告を提供
することができるものとする。
公衆衛生上の緊急事態の期間中、又は第 4 条(3)にい
5.
う重大事態の認定後、第 4 条(4)に従って重大事態に
の実際または潜在的な不足を防止または緩和するた
第 7 条にいうモニタリングの結果を、委員会と第 3 条
めに、各国の所轄官庁、販売承認者、その他の団体
(6)にいう単一の窓口に定期的に報告し、特に、重要
(必要に応じて医療従事者および患者の代表を含む)
医薬品リストに含まれる医薬品の実際の不足又は潜在
がとる措置を調整できる。
的不足、又は重大事態につながる可能性がある事象
を知らせるものとする。
第 9 条 医薬品の作業方法と情報提供について
第 1 号に掲げる報告書は、競争法に従い、適切な場
1.
合には、医薬品のサプライチェーンの他の関係者に
(a)
欧州委員会または第 3 条(6)にいう 1 つまたは複数の
(b)
第 4 条、第 7 条及び第 8 条に規定するモニタリング、
および結論を裏付けるために、集計データおよび需要
データ収集及び報告の方法及び基準を規定し、基本
予測を提供するものとする。この点に関して、MSSG
的な最小限のデータを設定すること;
は、以下を行うものとする:
(c)
ESMP が完全に機能するまでの間、関連する国の管轄
ESMP が完全に機能した時点で、ESMP のデータを使
当局と連携し、加盟国間で調和されたデータフィール
用する;
ドに基づき、他の既存の IT システム及び開発中の IT
ECDC と連携し、医薬品ニーズの予測に役立つ疫学
システムとの相互運用性を促進する合理的な IT モニ
データ、モデル、開発シナリオを入手する。
(c)
重要医薬品リストの設定と見直しの手順と基準を明記
する;
窓口から要請があった場合、MSSG は、その調査結果
(b)
第 4 条から第 8 条までの業務の遂行を準備するため、
EMA は、次の通りとする:
も提供することができる。
(a)
欧州委員会の要請があれば、MSSG は、公衆衛生上
の緊急事態または重大な出来事に関連して、医薬品
十分に対処したことが確認されるまでの間、MSSG は、
2.
MSSG は、自らの意思で、または欧州委員会もしくは加
第 17 条により設立された健康安全委員会、公衆衛
第 8 条 医薬品の供給不足に関する報告・勧告
1.
第 1 項及び第 2 項の報告の一環として、MSSG は、医
タリングする。
タリング及び報告システムを開発する;
重要医薬品リストに含まれる医薬品が医療機器と併用
(d)
される場合、第 21 条の医療機器の不足に関する執行
第 3 条(6)にいう作業部会を設置し、各加盟国がその
作業部会に代表されることを確保すること;
運営グループ(「MDSSG」)と連携する。
(e)
規則(EC) No 726/2004 の第 57 条(1)項(l)に規定する
第 1 号にいう集約されたデータ及び需要予測は、医
データベースにより、EU で認可されたすべての医薬品
薬品の実際の又は潜在的な不足をよりよく防止又は
の販売承認者の連絡先リストを作成し、維持する;
軽減することを目的として、競争法に従い、必要に応
241