よむ、つかう、まなぶ。
資料5-3 Ⅳ-144、145 フルダラビン[1.7MB] (55 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-144
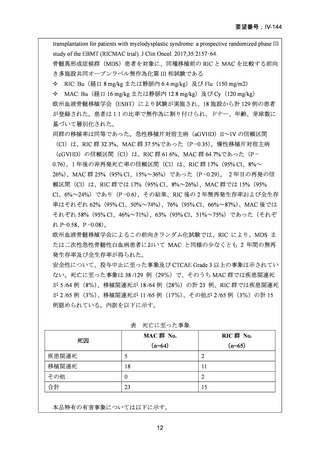
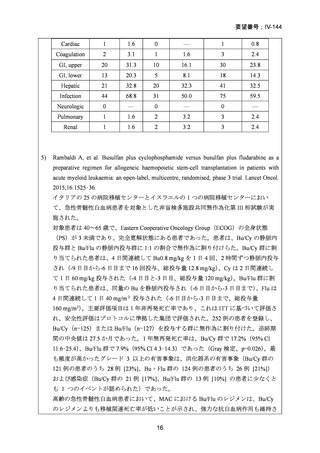
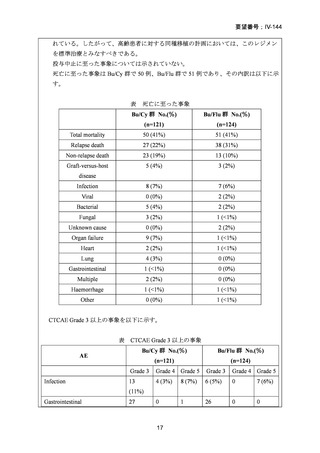
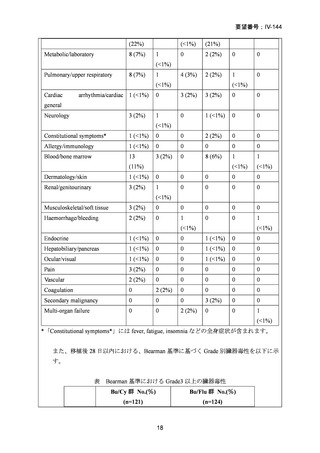
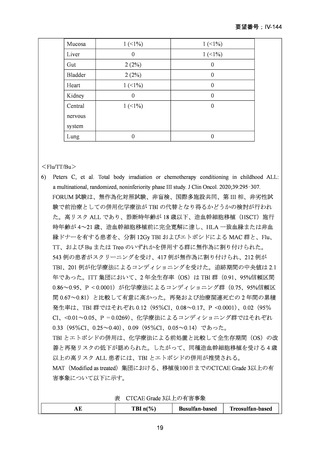
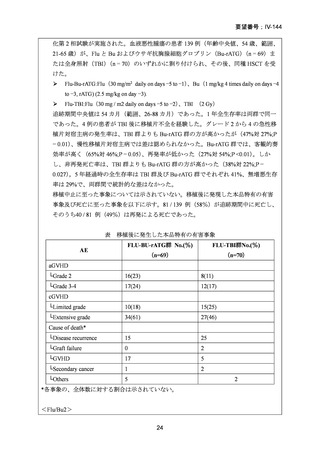
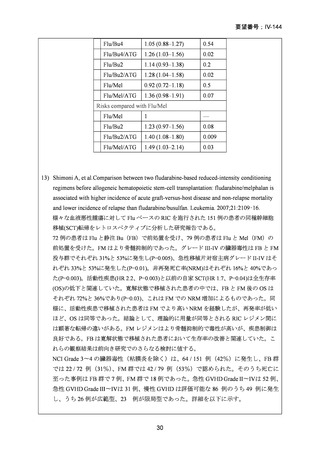
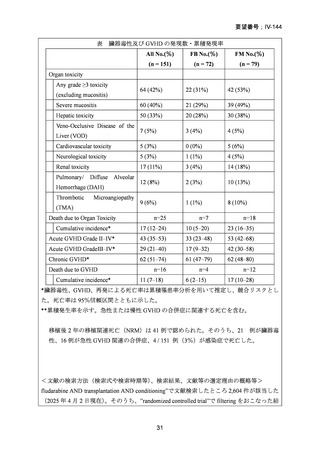
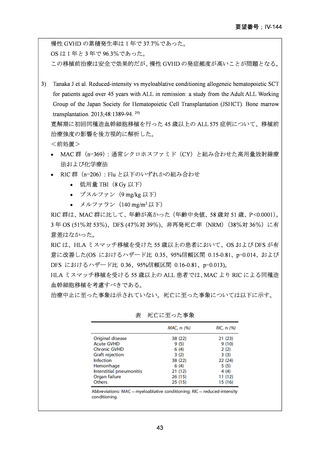
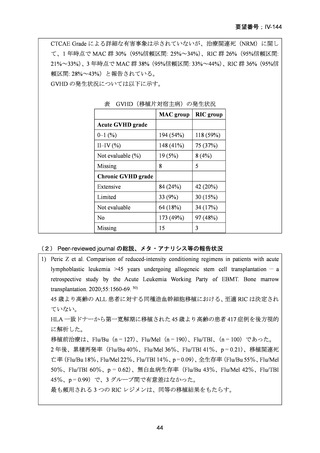
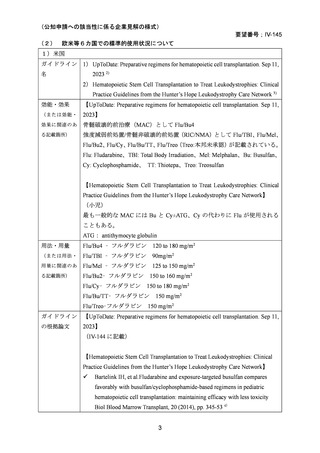
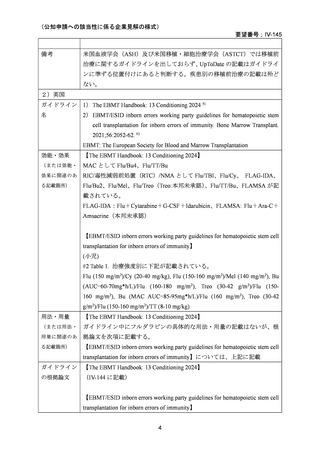
AA に対する臍帯血移植においては、わが国での後方視的検討にて前処置に ATG を使
用した症例の治療成績が不良であることが示されている。Yamamoto らは、移植前処置
として FLU(25 mg/m2/day × 5 days)+MEL(40 mg/m2/day × 2 days)+TBI 4Gy/2 fraction
(fr)を用いた成人 AA に対する臍帯血移植 12 例の治療成績を報告した。11 例で生着
が得られ、3 年全生存率は 83.3%であった。
一方、小児 AA 患者に対する臍帯血移植の前処置としては、FLU(25 mg/m2/day × 5 days)
+MEL(70mg/m2/day × 2 days)+TBI 3 Gy が推奨されている。
6.本邦での開発状況(経緯)及び使用実態について
(1)要望内容に係る本邦での開発状況(経緯)等について
本邦において要望内容に係る開発は行われていない。
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
1) (TRUMP)の解析において、2017 年から 2019 年の 3 年間で、小児 316 症例、成人 1,127
症例に、フルダラビンが適応外使用されていた 41)。また、
「5.要望内容に係る国内外の公
表文献・成書等について」に記載している。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
「5.要望内容に係る国内外の公表文献・成書等について(1)無作為化比較試験、薬物動
態試験等の公表論文としての報告状況」の項に記載のとおり、海外及び本邦における臨床
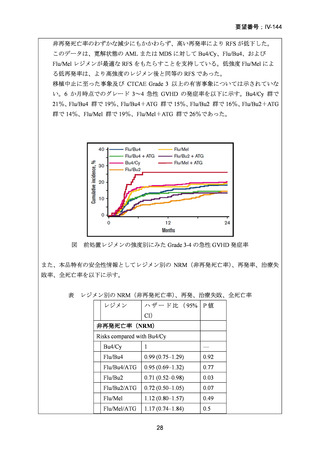
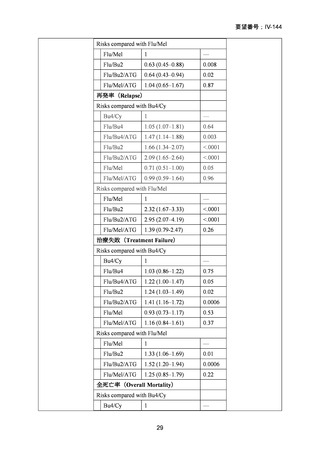
試験では、ALL 及び再生不良性貧血に対するフルダラビンの有効性が示されている。国内
外の文献報告間で患者背景、併用薬剤および放射線との組み合わせ等、前治療レジメンに
相違はあるものの、本剤が前治療薬の主要な薬剤の一つとして使用され、一定の有用性が
評価されていると考えられる。フルダラビンは、欧米等 6 カ国では承認されていないもの
の、日欧米等の診療ガイドライン及び教科書の記載内容、本邦及び海外臨床試験成績等か
ら、ALL 等に対する同種造血幹細胞移植の前治療(MAC 及び RIC/NMA)としてのフルダ
ラビンの投与は、欧米等において標準的治療に位置付けられていると考えられており、国
内外の医療環境の違い等を踏まえても国内における有効性が期待できると考えられる。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
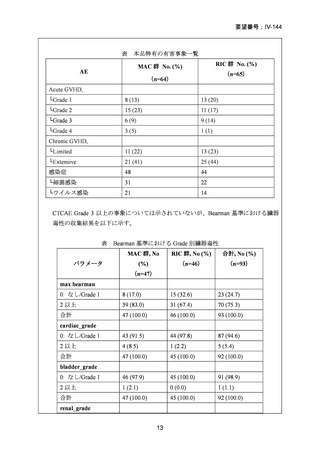
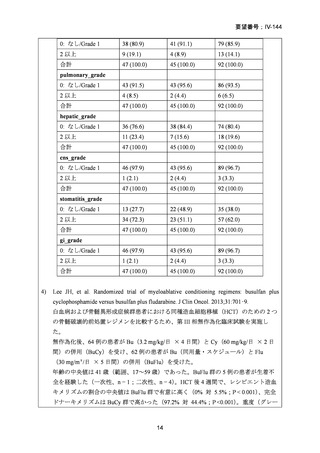
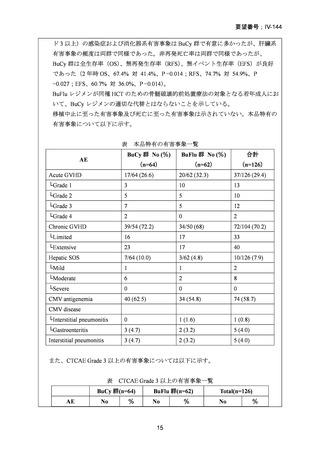
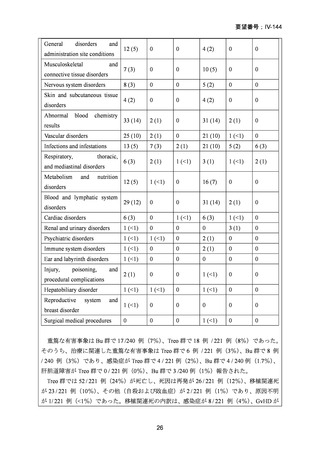
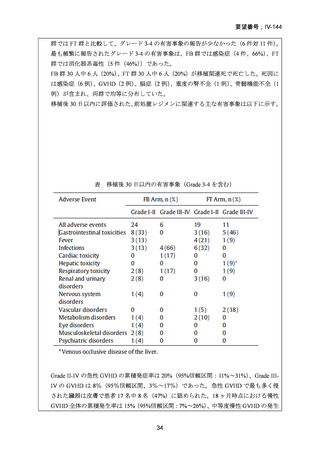
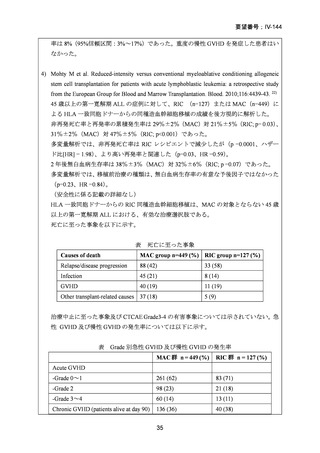
2008 年 5 月に「急性骨髄性白血病、骨髄異形成症候群、慢性骨髄性白血病、慢性リンパ性
白血病、悪性リンパ腫、多発性骨髄腫における同種造血幹細胞移植の前治療」の追加適応
51
AA に対する臍帯血移植においては、わが国での後方視的検討にて前処置に ATG を使
用した症例の治療成績が不良であることが示されている。Yamamoto らは、移植前処置
として FLU(25 mg/m2/day × 5 days)+MEL(40 mg/m2/day × 2 days)+TBI 4Gy/2 fraction
(fr)を用いた成人 AA に対する臍帯血移植 12 例の治療成績を報告した。11 例で生着
が得られ、3 年全生存率は 83.3%であった。
一方、小児 AA 患者に対する臍帯血移植の前処置としては、FLU(25 mg/m2/day × 5 days)
+MEL(70mg/m2/day × 2 days)+TBI 3 Gy が推奨されている。
6.本邦での開発状況(経緯)及び使用実態について
(1)要望内容に係る本邦での開発状況(経緯)等について
本邦において要望内容に係る開発は行われていない。
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
1) (TRUMP)の解析において、2017 年から 2019 年の 3 年間で、小児 316 症例、成人 1,127
症例に、フルダラビンが適応外使用されていた 41)。また、
「5.要望内容に係る国内外の公
表文献・成書等について」に記載している。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
「5.要望内容に係る国内外の公表文献・成書等について(1)無作為化比較試験、薬物動
態試験等の公表論文としての報告状況」の項に記載のとおり、海外及び本邦における臨床
試験では、ALL 及び再生不良性貧血に対するフルダラビンの有効性が示されている。国内
外の文献報告間で患者背景、併用薬剤および放射線との組み合わせ等、前治療レジメンに
相違はあるものの、本剤が前治療薬の主要な薬剤の一つとして使用され、一定の有用性が
評価されていると考えられる。フルダラビンは、欧米等 6 カ国では承認されていないもの
の、日欧米等の診療ガイドライン及び教科書の記載内容、本邦及び海外臨床試験成績等か
ら、ALL 等に対する同種造血幹細胞移植の前治療(MAC 及び RIC/NMA)としてのフルダ
ラビンの投与は、欧米等において標準的治療に位置付けられていると考えられており、国
内外の医療環境の違い等を踏まえても国内における有効性が期待できると考えられる。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
2008 年 5 月に「急性骨髄性白血病、骨髄異形成症候群、慢性骨髄性白血病、慢性リンパ性
白血病、悪性リンパ腫、多発性骨髄腫における同種造血幹細胞移植の前治療」の追加適応
51