よむ、つかう、まなぶ。
資料5-3 Ⅳ-144、145 フルダラビン[1.7MB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
資料 5-3
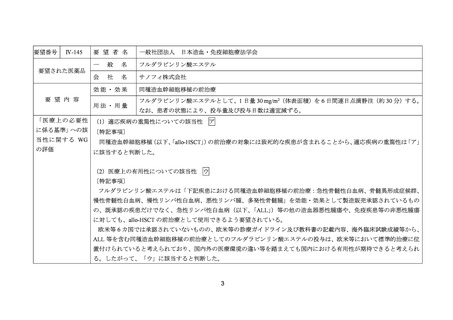
要望番号;IV-144 及び 145
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
フルダラビンリン酸エステル
造血幹細胞移植の前治療
1.要望内容の概略について
要 望 さ れ 一般名:フルダラビンリン酸エステル
た医薬品
販売名:フルダラ静注用 50 mg
会社名:サノフィ株式会社
要望者名
一般社団法人 日本造血・免疫細胞療法学会
要望内容
成人
効能・効果
小児
下記疾患における同種造血幹細胞移植の前治療
急性骨髄性白血病、骨髄異形成症候群、慢性骨髄性白血病、
慢性リンパ性白血病、悪性リンパ腫、多発性骨髄腫
(既承認の内容から取消線部削除)
用法・用量
フルダラビンリン酸エステルとして、1 日量 30 mg/m2(体表
面積)を 6 日間連日点滴静注(約 30 分)する。なお、患者の
状態により、投与量及び投与日数は適宜減ずる。
(既承認の内容から変更なし)
効能・効果及び なし
用法・用量以外
の要望内容(剤
形追加等)
備考
2.要望内容における医療上の必要性について
第 62 回「医療上の必要性の高い未承認薬・適応外薬検討会議」
(令和 7 年 3 月 14 日)
において、別添のとおり医療上の必要性の基準に該当すると判断した。
3.公知申請の妥当性について
企業見解を提出した企業は、公知申請の妥当性について以下のとおり説明している。
有効性について、国内外の臨床試験及び後方視的研究(別紙 1_Ⅳ-144 の企業見解 p8~
44 及び別紙 2_Ⅳ-145 の企業見解 p6~22)並びに国内外の教科書、診療ガイドライン、
公表論文から、成人又は小児において既承認の疾患以外の疾患に対しても同種造血幹
1
要望番号;IV-144 及び 145
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
フルダラビンリン酸エステル
造血幹細胞移植の前治療
1.要望内容の概略について
要 望 さ れ 一般名:フルダラビンリン酸エステル
た医薬品
販売名:フルダラ静注用 50 mg
会社名:サノフィ株式会社
要望者名
一般社団法人 日本造血・免疫細胞療法学会
要望内容
成人
効能・効果
小児
下記疾患における同種造血幹細胞移植の前治療
急性骨髄性白血病、骨髄異形成症候群、慢性骨髄性白血病、
慢性リンパ性白血病、悪性リンパ腫、多発性骨髄腫
(既承認の内容から取消線部削除)
用法・用量
フルダラビンリン酸エステルとして、1 日量 30 mg/m2(体表
面積)を 6 日間連日点滴静注(約 30 分)する。なお、患者の
状態により、投与量及び投与日数は適宜減ずる。
(既承認の内容から変更なし)
効能・効果及び なし
用法・用量以外
の要望内容(剤
形追加等)
備考
2.要望内容における医療上の必要性について
第 62 回「医療上の必要性の高い未承認薬・適応外薬検討会議」
(令和 7 年 3 月 14 日)
において、別添のとおり医療上の必要性の基準に該当すると判断した。
3.公知申請の妥当性について
企業見解を提出した企業は、公知申請の妥当性について以下のとおり説明している。
有効性について、国内外の臨床試験及び後方視的研究(別紙 1_Ⅳ-144 の企業見解 p8~
44 及び別紙 2_Ⅳ-145 の企業見解 p6~22)並びに国内外の教科書、診療ガイドライン、
公表論文から、成人又は小児において既承認の疾患以外の疾患に対しても同種造血幹
1