よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第181回先進医療技術審査部会
資料3-3
令和7年11月13日
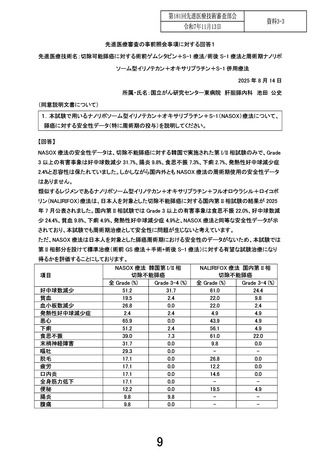
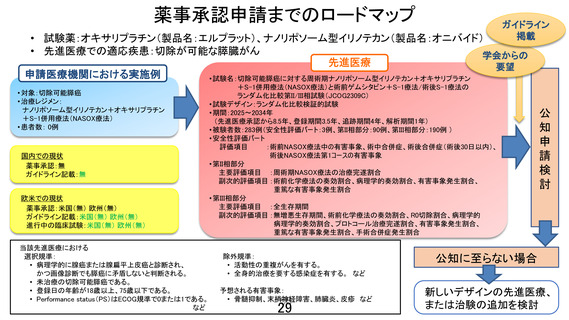
先進医療審査の事前照会事項に対する回答1
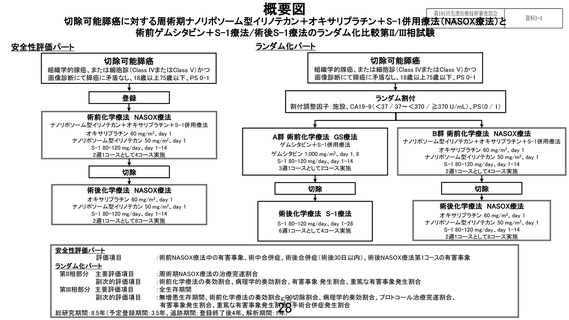
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 8 月 14 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
(同意説明文書について)
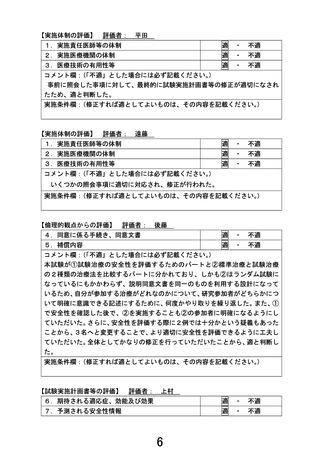
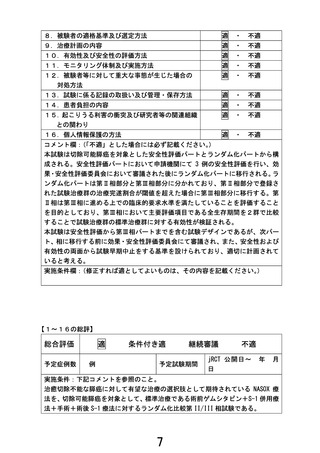
1.本試験で用いるナノリポソーム型イリノテカン+オキサリプラチン+S-1(NASOX)療法について、
膵癌に対する安全性データ(特に周術期の投与)を説明してください。
【回答】
NASOX 療法の安全性データは、切除不能膵癌に対する韓国で実施された第 I/II 相試験のみで、Grade
3 以上の有害事象は好中球数減少 31.7%、腸炎 9.8%、食思不振 7.3%、下痢 2.7%、発熱性好中球減少症
2.4%と忍容性は保たれていました。しかしながら国内外とも NASOX 療法の周術期使用の安全性データ
はありません。
類似するレジメンであるナノリポソーム型イリノテカン+オキサリプラチン+フルオロウラシル+ロイコボ
リン(NALIRIFOX)療法は、日本人を対象とした切除不能膵癌に対する国内第 II 相試験の結果が 2025
年 7 月公表されました。国内第 II 相試験では Grade 3 以上の有害事象は食思不振 22.0%、好中球数減
少 24.4%、貧血 9.8%、下痢 4.9%、発熱性好中球減少症 4.9%と、NASOX 療法と同等な安全性データが示
されており、本試験でも周術期治療として安全性に問題が生じないと考えています。
ただ、NASOX 療法は日本人を対象とした膵癌周術期における安全性のデータがないため、本試験では
第 II 相部分を設けて標準治療(術前 GS 療法+手術+術後 S-1 療法)に対する有望な試験治療になり
得るかを評価することにしております。
項目
好中球数減少
貧血
血小板数減少
発熱性好中球減少症
悪心
下痢
食思不振
末梢神経障害
嘔吐
脱毛
疲労
口内炎
全身筋力低下
便秘
腸炎
腹痛
NASOX 療法 韓国第 I/II 相
切除不能膵癌
全 Grade (%)
Grade 3-4 (%)
51.2
31.7
19.5
2.4
26.8
0.0
2.4
2.4
65.9
0.0
51.2
2.4
39.0
7.3
31.7
0.0
29.3
0.0
17.1
0.0
17.1
0.0
17.1
0.0
17.1
0.0
12.2
0.0
9.8
9.8
9.8
0.0
9
NALIRIFOX 療法 国内第 II 相
切除不能膵癌
全 Grade (%)
Grade 3-4 (%)
61.0
24.4
22.0
9.8
22.0
2.4
4.9
4.9
43.9
4.9
56.1
4.9
61.0
22.0
9.8
0.0
26.8
0.0
12.2
0.0
14.6
0.0
19.5
4.9
-
資料3-3
令和7年11月13日
先進医療審査の事前照会事項に対する回答1
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 8 月 14 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
(同意説明文書について)
1.本試験で用いるナノリポソーム型イリノテカン+オキサリプラチン+S-1(NASOX)療法について、
膵癌に対する安全性データ(特に周術期の投与)を説明してください。
【回答】
NASOX 療法の安全性データは、切除不能膵癌に対する韓国で実施された第 I/II 相試験のみで、Grade
3 以上の有害事象は好中球数減少 31.7%、腸炎 9.8%、食思不振 7.3%、下痢 2.7%、発熱性好中球減少症
2.4%と忍容性は保たれていました。しかしながら国内外とも NASOX 療法の周術期使用の安全性データ
はありません。
類似するレジメンであるナノリポソーム型イリノテカン+オキサリプラチン+フルオロウラシル+ロイコボ
リン(NALIRIFOX)療法は、日本人を対象とした切除不能膵癌に対する国内第 II 相試験の結果が 2025
年 7 月公表されました。国内第 II 相試験では Grade 3 以上の有害事象は食思不振 22.0%、好中球数減
少 24.4%、貧血 9.8%、下痢 4.9%、発熱性好中球減少症 4.9%と、NASOX 療法と同等な安全性データが示
されており、本試験でも周術期治療として安全性に問題が生じないと考えています。
ただ、NASOX 療法は日本人を対象とした膵癌周術期における安全性のデータがないため、本試験では
第 II 相部分を設けて標準治療(術前 GS 療法+手術+術後 S-1 療法)に対する有望な試験治療になり
得るかを評価することにしております。
項目
好中球数減少
貧血
血小板数減少
発熱性好中球減少症
悪心
下痢
食思不振
末梢神経障害
嘔吐
脱毛
疲労
口内炎
全身筋力低下
便秘
腸炎
腹痛
NASOX 療法 韓国第 I/II 相
切除不能膵癌
全 Grade (%)
Grade 3-4 (%)
51.2
31.7
19.5
2.4
26.8
0.0
2.4
2.4
65.9
0.0
51.2
2.4
39.0
7.3
31.7
0.0
29.3
0.0
17.1
0.0
17.1
0.0
17.1
0.0
17.1
0.0
12.2
0.0
9.8
9.8
9.8
0.0
9
NALIRIFOX 療法 国内第 II 相
切除不能膵癌
全 Grade (%)
Grade 3-4 (%)
61.0
24.4
22.0
9.8
22.0
2.4
4.9
4.9
43.9
4.9
56.1
4.9
61.0
22.0
9.8
0.0
26.8
0.0
12.2
0.0
14.6
0.0
19.5
4.9
-