よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
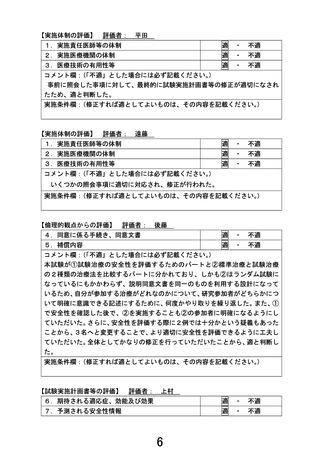
治療終了後の検査と評価項目
治療終了後の安全性評価
1)有害事象
プロトコール治療終了後は、以下の項目を評価する。
術後 31 日以降~治療終了後 3 年:3 か月毎。前後 1 か月までを許容する。
治療終了後 3 年~5 年:6 か月毎。前後 2 か月までを許容する。
治療終了後 5 年~:1 年毎。前後 3 か月までを許容する。
① 術前化学療法のみでプロトコール治療中止になった場合で、プロトコール治療中止後 31 日以降は、Grade
3 以上の有害反応が認められた場合、Grade 1 以上の有害反応の治療のために 24 時間以上の入院/入院期間
の延長が必要となった場合、についてはその内容を診療録に記載し、追跡調査に入力する。
術後化学療法を実施した場合で、術後化学療法完了/中止後 31 日以降は、Grade 3 以上の有害反応が認め
られた場合、Grade 1 以上の有害反応の治療のために 24 時間以上の入院/入院期間の延長が必要となった場
合、についてはその内容を診療録に記載し、追跡調査に入力する。
2)全身状態
プロトコール治療終了後は、以下の項目を評価する。
治療終了後~治療終了後 3 年:3 か月毎。前後 1 か月までを許容する。
治療終了後 3 年~5 年:6 か月毎。前後 2 か月までを許容する。
治療終了後 5 年~:1 年毎。前後 3 か月までを許容する。
① PS(ECOG)
3)後治療に関する情報
後治療について、以下の項目を評価する。
・ 後治療の有無
・ 後治療の内容(後治療を行った場合)
・ プロトコール治療中止後最初の後治療開始日(後治療を行った場合)
・ 後治療開始時の PS(後治療を行った場合)
治療終了後の有効性評価
1) 検査内容
① 胸部(単純または造影)CT
② 腹部・骨盤造影 CT※
※ 登録時には CT 造影剤アレルギーを有しなかったが本試験登録後に CT 造影剤アレルギーが生じた場合に
は造影 MRI でも可。腎機能障害、気管支喘息が原因で造影検査自体が不可能となった場合には、単純 CT、単
純 MRI も許容する。
③ 腫瘍マーカー:CEA、CA19-9、DUPAN-2
2) 評価間隔
プロトコール治療が中止/完了となった場合、無増悪生存期間のイベントが観察されるまで以下の評価間隔で
有効性評価を継続する。
治療終了後~治療終了後 3 年:3 か月ごと。前後 1 か月までを許容する。
治療終了後 3 年~5 年:6 か月ごと。前後 2 か月までを許容する。
治療終了後 5 年~:1 年毎。前後 3 か月までを許容する。
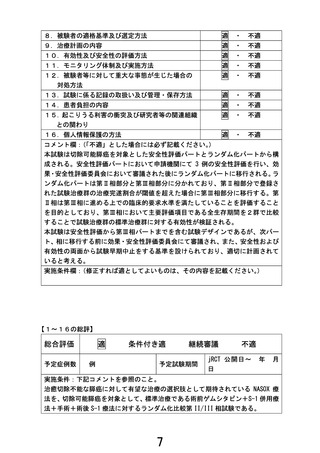
追跡調査
生存時間(time-to-event)
全生存期間
無増悪生存期間
無イベント生存の確認
最終生存確認日
臨床的に増悪がないことが確認された最終日
備考
電話連絡のみも可
電話連絡のみは不可
追跡調査は本試験の登録終了後 3 年まで実施するため、個々の患者の登録後 3 年以降も CRF の締め切り日に
従って報告する。
1)追跡調査時の転帰確認
生存確認は患者本人の外来受診の他、患者への電話連絡による生存確認も可。ただし電話連絡による生存確
認を行った場合は、そのことを診療録に記録すること。全生存期間のイベントの取り扱いについての詳細は試
験実施計画書を参照。
2)追跡調査時の増悪の確認
増悪の有無の確認は画像検査や検体検査による増悪の有無の確認は必須とせず、外来診察等での臨床的な確
認でよい。ただし、患者本人への電話連絡による確認のみは不可とする。転院先または紹介先の医療機関など
38
治療終了後の安全性評価
1)有害事象
プロトコール治療終了後は、以下の項目を評価する。
術後 31 日以降~治療終了後 3 年:3 か月毎。前後 1 か月までを許容する。
治療終了後 3 年~5 年:6 か月毎。前後 2 か月までを許容する。
治療終了後 5 年~:1 年毎。前後 3 か月までを許容する。
① 術前化学療法のみでプロトコール治療中止になった場合で、プロトコール治療中止後 31 日以降は、Grade
3 以上の有害反応が認められた場合、Grade 1 以上の有害反応の治療のために 24 時間以上の入院/入院期間
の延長が必要となった場合、についてはその内容を診療録に記載し、追跡調査に入力する。
術後化学療法を実施した場合で、術後化学療法完了/中止後 31 日以降は、Grade 3 以上の有害反応が認め
られた場合、Grade 1 以上の有害反応の治療のために 24 時間以上の入院/入院期間の延長が必要となった場
合、についてはその内容を診療録に記載し、追跡調査に入力する。
2)全身状態
プロトコール治療終了後は、以下の項目を評価する。
治療終了後~治療終了後 3 年:3 か月毎。前後 1 か月までを許容する。
治療終了後 3 年~5 年:6 か月毎。前後 2 か月までを許容する。
治療終了後 5 年~:1 年毎。前後 3 か月までを許容する。
① PS(ECOG)
3)後治療に関する情報
後治療について、以下の項目を評価する。
・ 後治療の有無
・ 後治療の内容(後治療を行った場合)
・ プロトコール治療中止後最初の後治療開始日(後治療を行った場合)
・ 後治療開始時の PS(後治療を行った場合)
治療終了後の有効性評価
1) 検査内容
① 胸部(単純または造影)CT
② 腹部・骨盤造影 CT※
※ 登録時には CT 造影剤アレルギーを有しなかったが本試験登録後に CT 造影剤アレルギーが生じた場合に
は造影 MRI でも可。腎機能障害、気管支喘息が原因で造影検査自体が不可能となった場合には、単純 CT、単
純 MRI も許容する。
③ 腫瘍マーカー:CEA、CA19-9、DUPAN-2
2) 評価間隔
プロトコール治療が中止/完了となった場合、無増悪生存期間のイベントが観察されるまで以下の評価間隔で
有効性評価を継続する。
治療終了後~治療終了後 3 年:3 か月ごと。前後 1 か月までを許容する。
治療終了後 3 年~5 年:6 か月ごと。前後 2 か月までを許容する。
治療終了後 5 年~:1 年毎。前後 3 か月までを許容する。
追跡調査
生存時間(time-to-event)
全生存期間
無増悪生存期間
無イベント生存の確認
最終生存確認日
臨床的に増悪がないことが確認された最終日
備考
電話連絡のみも可
電話連絡のみは不可
追跡調査は本試験の登録終了後 3 年まで実施するため、個々の患者の登録後 3 年以降も CRF の締め切り日に
従って報告する。
1)追跡調査時の転帰確認
生存確認は患者本人の外来受診の他、患者への電話連絡による生存確認も可。ただし電話連絡による生存確
認を行った場合は、そのことを診療録に記録すること。全生存期間のイベントの取り扱いについての詳細は試
験実施計画書を参照。
2)追跡調査時の増悪の確認
増悪の有無の確認は画像検査や検体検査による増悪の有無の確認は必須とせず、外来診察等での臨床的な確
認でよい。ただし、患者本人への電話連絡による確認のみは不可とする。転院先または紹介先の医療機関など
38