よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療審査の事前照会事項に対する回答9
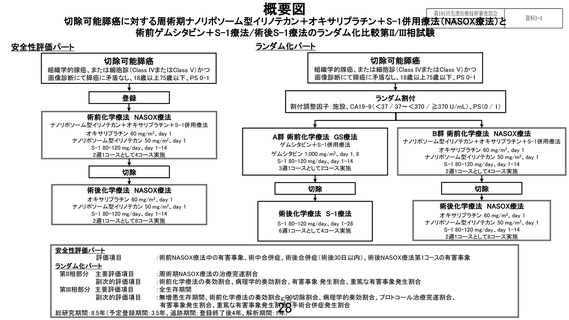
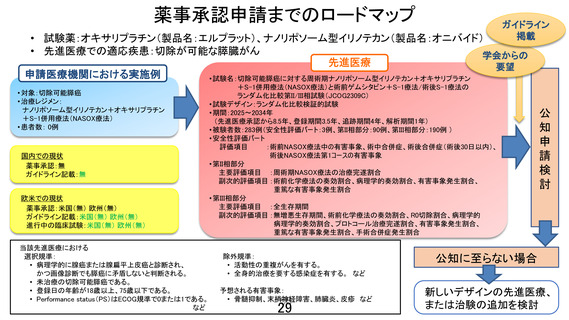
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 10 月 10 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
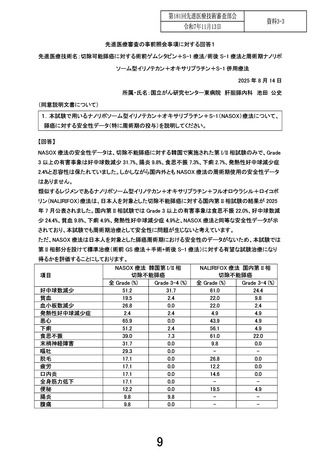
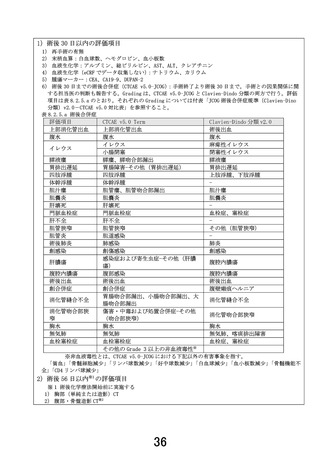
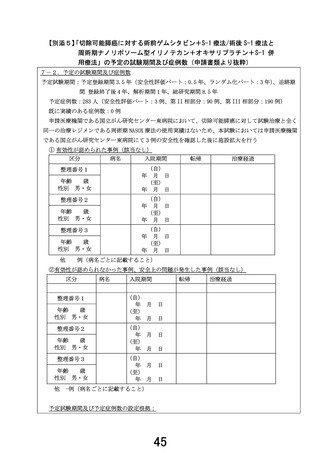
1. 本試験は術前 NASOX 療法+手術+術後 NASOX 療法の有効性及び安全性を評価する試験で
あるが、安全性評価パートでは術前 NASOX 療法開始から術後 30 日までの安全性を評価することと
なっている。先進医療として継続の判断するのに、安全性評価パートの術後 NASOX 療法のデータは
必要であることから、安全性評価パートの設定を再考いただきたい。
【回答】
ご指摘ありがとうございます。安全性評価パートにおいて術後 NASOX 療法のデータを含めることの重
要性について、承知いたしました。ご指摘を踏まえまして、安全性評価パートの評価期間について、術前
NASOX 療法開始時点から術後 30 日までの期間ではなく、術前 NASOX 療法開始時点から、周術期も
含めて、術後 NASOX 療法 1 コース目終了(2 コース目開始直前)時点までの期間に変更することといた
します。加えて、安全性評価パートの結果に基づいて、先進医療としての継続についてご審議いただく
際には、その時点で得られているすべての安全性情報を踏まえて検討した結果も提出させていただきま
す。
また、9 月 17 日付けの事前照会事項 8 でいただきましたご指摘を踏まえ、安全性評価パートの予定
登録数を 2 例から 3 例へ修正しております。さらに、当該 3 例の結果を評価した時点で、術後 NASOX 療
法を含む安全性評価の情報が十分に得られていないと判断される場合(例えば、術後 NASOX 投与例
が 1 例のみであった場合や術後 NASOX 投与例が 2 例のみかつ術後 NASOX 療法の有害事象に懸念
があり、追加評価が適切と考えられる場合等)には、安全性評価パートの登録数を適宜追加した上で、
先進医療としての継続についてのご審議をお願いしたいと考えております。なお、安全性評価パートに
おける安全性及び登録数追加の要否については、本試験の研究グループの委員を除く JCOG 効果・安
全性評価委員会(https://jcog.jp/org/committee/jury/)による審査を受ける予定とします。
以上
25
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 10 月 10 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
1. 本試験は術前 NASOX 療法+手術+術後 NASOX 療法の有効性及び安全性を評価する試験で
あるが、安全性評価パートでは術前 NASOX 療法開始から術後 30 日までの安全性を評価することと
なっている。先進医療として継続の判断するのに、安全性評価パートの術後 NASOX 療法のデータは
必要であることから、安全性評価パートの設定を再考いただきたい。
【回答】
ご指摘ありがとうございます。安全性評価パートにおいて術後 NASOX 療法のデータを含めることの重
要性について、承知いたしました。ご指摘を踏まえまして、安全性評価パートの評価期間について、術前
NASOX 療法開始時点から術後 30 日までの期間ではなく、術前 NASOX 療法開始時点から、周術期も
含めて、術後 NASOX 療法 1 コース目終了(2 コース目開始直前)時点までの期間に変更することといた
します。加えて、安全性評価パートの結果に基づいて、先進医療としての継続についてご審議いただく
際には、その時点で得られているすべての安全性情報を踏まえて検討した結果も提出させていただきま
す。
また、9 月 17 日付けの事前照会事項 8 でいただきましたご指摘を踏まえ、安全性評価パートの予定
登録数を 2 例から 3 例へ修正しております。さらに、当該 3 例の結果を評価した時点で、術後 NASOX 療
法を含む安全性評価の情報が十分に得られていないと判断される場合(例えば、術後 NASOX 投与例
が 1 例のみであった場合や術後 NASOX 投与例が 2 例のみかつ術後 NASOX 療法の有害事象に懸念
があり、追加評価が適切と考えられる場合等)には、安全性評価パートの登録数を適宜追加した上で、
先進医療としての継続についてのご審議をお願いしたいと考えております。なお、安全性評価パートに
おける安全性及び登録数追加の要否については、本試験の研究グループの委員を除く JCOG 効果・安
全性評価委員会(https://jcog.jp/org/committee/jury/)による審査を受ける予定とします。
以上
25