よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療審査の事前照会事項に対する回答7
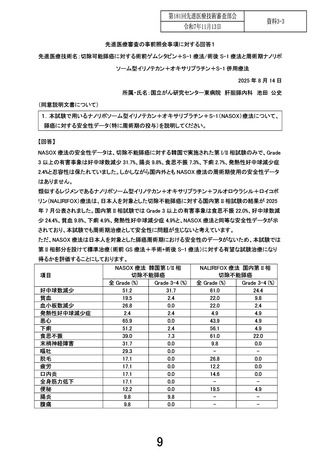
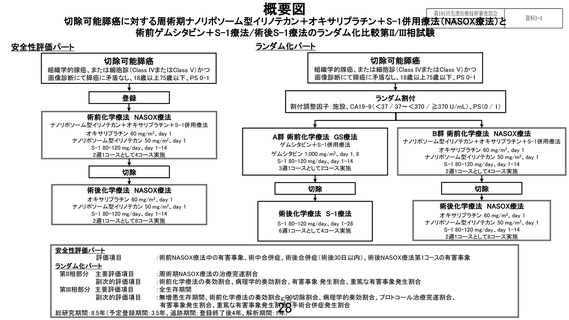
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 9 月 3 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
1. 今回、申請された技術は、「未承認若しくは適応外の医薬品、医療機器又は再生医療等製品を
用いる医療技術に係る留意事項」の中で、高度で質の高い臨床研究を実施することができる保険医
療機関において、当該医療技術を有効かつ安全に実施できることが明らかである場合には、数例以
上の臨床使用実績が無い場合であっても、申請は可能としていることから申請がなされている。
今回、先進医療として数例の実施を行った後に、先進医療の継続の可否を評価すること計画となって
いるが、その数例が現在提示されている 2 例では、先進医療技術審査部会として先進医療の継続に
ついて評価することは困難と考える。特に、本プロトコル治療は「術前 NASOX 療法+手術+術後
NASOX 療法」により構成されており、術前化学療法の中止等の理由により術後化学療法に至らない
症例が生じることも想定される。安全性評価パートの症例数を再考頂きたいが、いかがか。
【回答】
安全性評価パートの登録数について追加のご意見をいただきありがとうございます。NASOX 療法は本
邦での使用実績がないことから、ご指摘の通り、安全性に関してより多くの情報があることは重要と考え
ております。一方で、本試験に参加いただく患者さんの安全を最優先に考えた場合、初期の安全性評価
の報告が遅くなることは望ましくないと考えます。そのため、まずは 2 例に対して試験治療を行い、その
結果を速やかに報告することで早期に安全性情報を共有させていただき、続く第 II 相部分に移行した後、
最初に発行する「定期モニタリングレポート(プロトコール 14.1;重篤な有害事象、有害反応/有害事象等
の発現状況を含む文書)」を追加で提出することで、より多くの患者に基づく安全性の情報を補足させて
いただきたいと考えております。
以上
22
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 9 月 3 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
1. 今回、申請された技術は、「未承認若しくは適応外の医薬品、医療機器又は再生医療等製品を
用いる医療技術に係る留意事項」の中で、高度で質の高い臨床研究を実施することができる保険医
療機関において、当該医療技術を有効かつ安全に実施できることが明らかである場合には、数例以
上の臨床使用実績が無い場合であっても、申請は可能としていることから申請がなされている。
今回、先進医療として数例の実施を行った後に、先進医療の継続の可否を評価すること計画となって
いるが、その数例が現在提示されている 2 例では、先進医療技術審査部会として先進医療の継続に
ついて評価することは困難と考える。特に、本プロトコル治療は「術前 NASOX 療法+手術+術後
NASOX 療法」により構成されており、術前化学療法の中止等の理由により術後化学療法に至らない
症例が生じることも想定される。安全性評価パートの症例数を再考頂きたいが、いかがか。
【回答】
安全性評価パートの登録数について追加のご意見をいただきありがとうございます。NASOX 療法は本
邦での使用実績がないことから、ご指摘の通り、安全性に関してより多くの情報があることは重要と考え
ております。一方で、本試験に参加いただく患者さんの安全を最優先に考えた場合、初期の安全性評価
の報告が遅くなることは望ましくないと考えます。そのため、まずは 2 例に対して試験治療を行い、その
結果を速やかに報告することで早期に安全性情報を共有させていただき、続く第 II 相部分に移行した後、
最初に発行する「定期モニタリングレポート(プロトコール 14.1;重篤な有害事象、有害反応/有害事象等
の発現状況を含む文書)」を追加で提出することで、より多くの患者に基づく安全性の情報を補足させて
いただきたいと考えております。
以上
22