よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療審査の事前照会事項に対する回答6
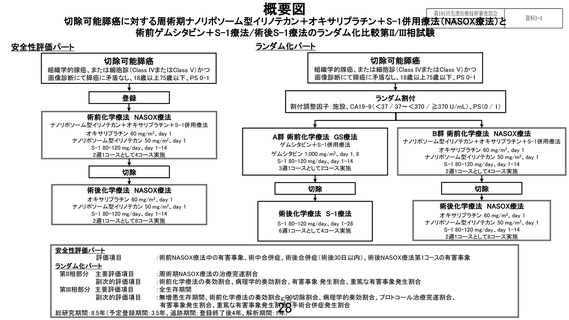
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 9 月 1 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
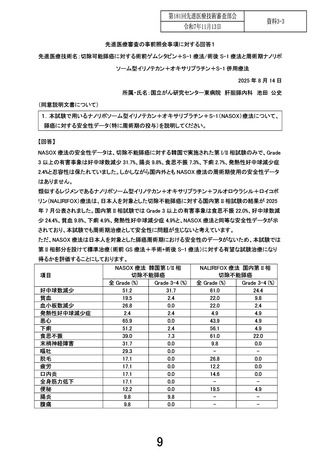
1.術後 NASOX 療法については本邦で使用されたことがなく、その副作用発現については未知数で
ある。一般的に、術後は手術侵襲や臓器予備能低下のため、同じレジメンでも副作用が強く出やす
い傾向があることも考慮し、安全性の担保をより重視していただきたいと考える。安全性評価パート
の症例数を 10~15 例に増やしていただきたいが、いかがか。
【回答】
ご指摘の通り、NASOX 療法は本邦での使用経験がなく、切除可能膵癌における周術期 NASOX 療法の
安全性は分かっておりません。そのため NASOX 療法の安全性の確認は重要と考えており、プロトコー
ルの 2.4.1.に記載しておりますように、本試験は第 III 相試験ではなく、第 II/III 相試験として、第 II 相部
分を設け、治療完遂割合や有害事象等の安全性を評価する計画としております。それに先立つ安全性
評価パートの 2 例は、厚労省 Web ページに掲載されている「先進医療実施に係る Q&A」の 5 番(数例
以上の臨床使用実績について説明されている項:https://www.mhlw.go.jp/seisakunitsuite/bunya/kenko
u_iryou/iryouhoken/sensiniryo/minaoshi/dl/qanda.pdf)に基づき設定しました。このパートの 2 例は、申
請医療機関・臨床研究中核病院である国立がん研究センター東病院のみで実施し、その結果を踏ま
え、多施設で行う第 II 相部分に移行します。先進医療の通知等を拝見する限り、形式的にはこの 2 例
の後に第 III 相部分に進むことも可能とも考えられます。しかし、NASOX 療法の安全性の評価が十分で
はないと考えており、第 II 相部分で試験治療群(NASOX 療法群)として 45 例で治療完遂割合を評価す
ることで、安全性ならびに有効性を確認した上で第 III 相部分に進むこととしております。以上のことか
ら、安全性評価パートは 2 例で考えておりますが、第 II 相部分の 45 例でも、引き続き安全性の評価を
行います。なお、本試験のプロトコール 14.1.に定めておりますように、年 2 回の定期モニタリングを実施
することとしており、重篤ではない事象も含め、第 II 相部分の進捗中も、参加医療機関間での安全性デ
ータの共有を行いつつ進める計画としております。
以上
21
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 9 月 1 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
1.術後 NASOX 療法については本邦で使用されたことがなく、その副作用発現については未知数で
ある。一般的に、術後は手術侵襲や臓器予備能低下のため、同じレジメンでも副作用が強く出やす
い傾向があることも考慮し、安全性の担保をより重視していただきたいと考える。安全性評価パート
の症例数を 10~15 例に増やしていただきたいが、いかがか。
【回答】
ご指摘の通り、NASOX 療法は本邦での使用経験がなく、切除可能膵癌における周術期 NASOX 療法の
安全性は分かっておりません。そのため NASOX 療法の安全性の確認は重要と考えており、プロトコー
ルの 2.4.1.に記載しておりますように、本試験は第 III 相試験ではなく、第 II/III 相試験として、第 II 相部
分を設け、治療完遂割合や有害事象等の安全性を評価する計画としております。それに先立つ安全性
評価パートの 2 例は、厚労省 Web ページに掲載されている「先進医療実施に係る Q&A」の 5 番(数例
以上の臨床使用実績について説明されている項:https://www.mhlw.go.jp/seisakunitsuite/bunya/kenko
u_iryou/iryouhoken/sensiniryo/minaoshi/dl/qanda.pdf)に基づき設定しました。このパートの 2 例は、申
請医療機関・臨床研究中核病院である国立がん研究センター東病院のみで実施し、その結果を踏ま
え、多施設で行う第 II 相部分に移行します。先進医療の通知等を拝見する限り、形式的にはこの 2 例
の後に第 III 相部分に進むことも可能とも考えられます。しかし、NASOX 療法の安全性の評価が十分で
はないと考えており、第 II 相部分で試験治療群(NASOX 療法群)として 45 例で治療完遂割合を評価す
ることで、安全性ならびに有効性を確認した上で第 III 相部分に進むこととしております。以上のことか
ら、安全性評価パートは 2 例で考えておりますが、第 II 相部分の 45 例でも、引き続き安全性の評価を
行います。なお、本試験のプロトコール 14.1.に定めておりますように、年 2 回の定期モニタリングを実施
することとしており、重篤ではない事象も含め、第 II 相部分の進捗中も、参加医療機関間での安全性デ
ータの共有を行いつつ進める計画としております。
以上
21