よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第181回先進医療技術審査部会
(別紙1)
先進医療 B
評価委員
主担当: 平田
副担当: 後藤
令和7年11月13日
資料3-2
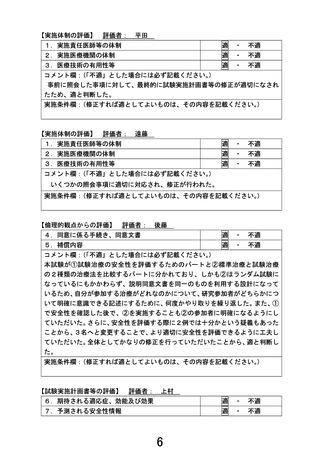
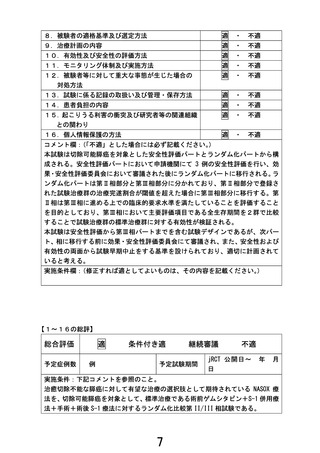
実施計画等評価表(番号 B150)
副担当: 上村
技術専門委員: 遠藤
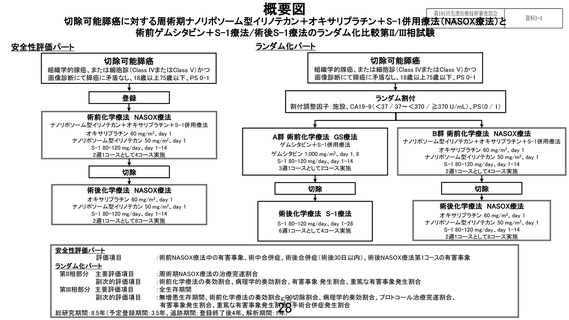
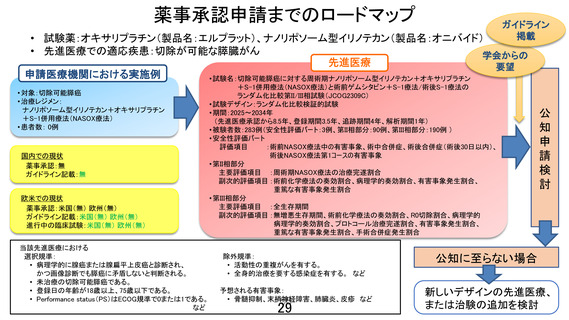
先進医療の名称
切除可能膵癌に対する術前ゲムシタビン+S-1療法/術後S-1療
法と周術期ナノリポソーム型イリノテカン+オキサリプラチン
+S-1併用療法
申請医療機関
国立がん研究センター東病院
医療技術の概要
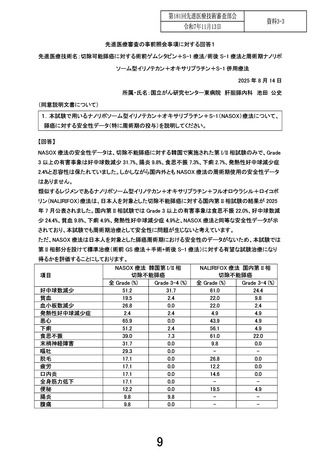
現在の本邦における切除可能膵癌の標準治療は、術前ゲムシ
タビン+S-1(GS)療法+手術+術後 S-1 療法である。本試験で
は、
【安全性評価パート】において、切除不能膵癌において標準
治療として広く用いられる GEM+ナブパクリタキセル(nabPTX)療法と比較し全生存期間での有益性が示された NalIRIFOX
(ナノリポソーム型イリノテカン+5-FU+LV+オキサリプラチ
ン)療法の 5-FU 持続点滴と LV 点滴を内服抗がん薬である S-1
に換えた NASOX(ナノリポソーム型イリノテカン+オキサリプ
ラチン+S-1)療法の安全性を評価し、その後【ランダム化パー
ト】において、NASOX 療法の標準治療に対する全生存期間にお
ける優越性を検証する。
○主要評価項目:
【安全性評価パート】
評価項目:術前 NASOX 療法中の有害事象、術中合併症、術後合
併症(術後 30 日以内)
【ランダム化パート】
第Ⅱ相部分
主要評価項目:周術期 NASOX 療法の治療完遂割合
副次評価項目:術前化学療法の奏効割合、病理学的奏効割合、
有害事象発生割合、重篤な有害事象発生割合
第Ⅲ相部分
主要評価項目:全生存期間
副次評価項目:無増悪生存期間、術前化学療法の奏効割合、
R0 切除割合、病理学的奏効割合、プロトコー
ル治療完遂割合、有害事象発生割合、重篤な
有害事象発生割合、手術合併症発生割合(術
中、術後 30 日以内、術後 90 日以内)
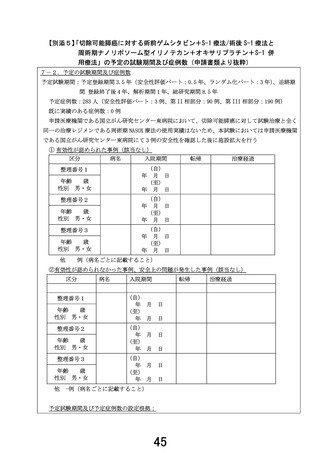
○予定試験期間:jRCT 公開日~2034 年3月 31 日
○目標症例数:282 例
5
(別紙1)
先進医療 B
評価委員
主担当: 平田
副担当: 後藤
令和7年11月13日
資料3-2
実施計画等評価表(番号 B150)
副担当: 上村
技術専門委員: 遠藤
先進医療の名称
切除可能膵癌に対する術前ゲムシタビン+S-1療法/術後S-1療
法と周術期ナノリポソーム型イリノテカン+オキサリプラチン
+S-1併用療法
申請医療機関
国立がん研究センター東病院
医療技術の概要
現在の本邦における切除可能膵癌の標準治療は、術前ゲムシ
タビン+S-1(GS)療法+手術+術後 S-1 療法である。本試験で
は、
【安全性評価パート】において、切除不能膵癌において標準
治療として広く用いられる GEM+ナブパクリタキセル(nabPTX)療法と比較し全生存期間での有益性が示された NalIRIFOX
(ナノリポソーム型イリノテカン+5-FU+LV+オキサリプラチ
ン)療法の 5-FU 持続点滴と LV 点滴を内服抗がん薬である S-1
に換えた NASOX(ナノリポソーム型イリノテカン+オキサリプ
ラチン+S-1)療法の安全性を評価し、その後【ランダム化パー
ト】において、NASOX 療法の標準治療に対する全生存期間にお
ける優越性を検証する。
○主要評価項目:
【安全性評価パート】
評価項目:術前 NASOX 療法中の有害事象、術中合併症、術後合
併症(術後 30 日以内)
【ランダム化パート】
第Ⅱ相部分
主要評価項目:周術期 NASOX 療法の治療完遂割合
副次評価項目:術前化学療法の奏効割合、病理学的奏効割合、
有害事象発生割合、重篤な有害事象発生割合
第Ⅲ相部分
主要評価項目:全生存期間
副次評価項目:無増悪生存期間、術前化学療法の奏効割合、
R0 切除割合、病理学的奏効割合、プロトコー
ル治療完遂割合、有害事象発生割合、重篤な
有害事象発生割合、手術合併症発生割合(術
中、術後 30 日以内、術後 90 日以内)
○予定試験期間:jRCT 公開日~2034 年3月 31 日
○目標症例数:282 例
5