よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療審査の事前照会事項に対する回答5
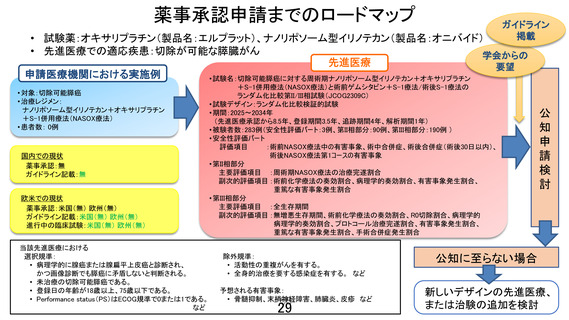
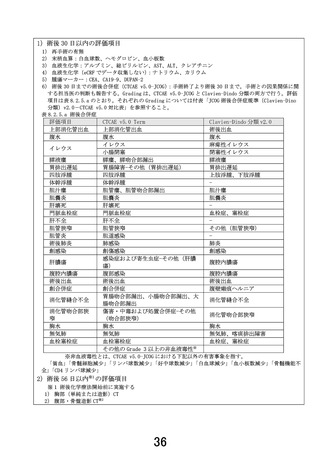
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 8 月 27 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
1.術後補助療法として NASOX 療法を行うようですが、術後 NASOX 療法の安全性は証明されている
のでしょうか。安全性評価パートで2例実施するようですが、術後 NASOX の治療関連副作用につい
ての評価は2例で十分なのでしょうか。
【回答】
ご指摘の通り、術後 NASOX 療法の安全性は証明されておらず、術後 NASOX 療法の副作用評価は
2 例で十分ではないと考えております。安全性評価パートは、申請医療機関である国立がん研究センタ
ー東病院における周術期 NASOX 療法の使用成績がないため設定しておりますが、患者数の設定につ
いて明確な統計学的根拠はありません。しかし、類似するレジメンである FOLFIRINOX 療法や S-IROX
療法などの進行膵癌での本邦における使用経験や、韓国での NASOX 療法の結果を踏まえ、安全性に
おいては蓋然性があるものと考えております。このため、2 例の使用実績を基に先進医療として継続す
るかどうか(ランダム化パートに進むかどうか)の安全性評価を行うことは妥当であると判断しています。
なお、安全性評価パートでは術前 NASOX 療法開始から術後 30 日までの安全性評価、具体的には術前
NASOX 療法中の有害事象、術中合併症、術後合併症(術後 30 日以内)を評価することとしております。
術後化学療法は、術前化学療法と同一レジメンである NASOX 療法であることや、術前 NASOX 療法で
有害事象による減量があれば術後も同様の用量レベルで実施されることから忍容性が確保できると考
え上記の設定といたしました。また、切除可能膵癌に対する NASOX 療法を用いた周術期治療としての
安全性は、より多数の患者でランダム化パートの第 II 相部分で評価する予定です。試験開始後は年 2
回に発行される定期モニタリングレポートにより、安全性が想定より大きく劣っていないかどうかを確認
いたします。
2.同意書の3ページ目9行目までに NASOX の副作用について説明されています。NAPOLI3 ではア
ジア人の対象者は少ないものの、治療関連死亡が2%報告されています。これを追記すべきだと思い
ます。同じく同意書の8ページの表に NASOX 群の術後化学療法における副作用について書かれて
いますが、これはどの文献からの引用なのでしょうか。患者さんは術後 NASOX は術前と同様の副作
19
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 8 月 27 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
1.術後補助療法として NASOX 療法を行うようですが、術後 NASOX 療法の安全性は証明されている
のでしょうか。安全性評価パートで2例実施するようですが、術後 NASOX の治療関連副作用につい
ての評価は2例で十分なのでしょうか。
【回答】
ご指摘の通り、術後 NASOX 療法の安全性は証明されておらず、術後 NASOX 療法の副作用評価は
2 例で十分ではないと考えております。安全性評価パートは、申請医療機関である国立がん研究センタ
ー東病院における周術期 NASOX 療法の使用成績がないため設定しておりますが、患者数の設定につ
いて明確な統計学的根拠はありません。しかし、類似するレジメンである FOLFIRINOX 療法や S-IROX
療法などの進行膵癌での本邦における使用経験や、韓国での NASOX 療法の結果を踏まえ、安全性に
おいては蓋然性があるものと考えております。このため、2 例の使用実績を基に先進医療として継続す
るかどうか(ランダム化パートに進むかどうか)の安全性評価を行うことは妥当であると判断しています。
なお、安全性評価パートでは術前 NASOX 療法開始から術後 30 日までの安全性評価、具体的には術前
NASOX 療法中の有害事象、術中合併症、術後合併症(術後 30 日以内)を評価することとしております。
術後化学療法は、術前化学療法と同一レジメンである NASOX 療法であることや、術前 NASOX 療法で
有害事象による減量があれば術後も同様の用量レベルで実施されることから忍容性が確保できると考
え上記の設定といたしました。また、切除可能膵癌に対する NASOX 療法を用いた周術期治療としての
安全性は、より多数の患者でランダム化パートの第 II 相部分で評価する予定です。試験開始後は年 2
回に発行される定期モニタリングレポートにより、安全性が想定より大きく劣っていないかどうかを確認
いたします。
2.同意書の3ページ目9行目までに NASOX の副作用について説明されています。NAPOLI3 ではア
ジア人の対象者は少ないものの、治療関連死亡が2%報告されています。これを追記すべきだと思い
ます。同じく同意書の8ページの表に NASOX 群の術後化学療法における副作用について書かれて
いますが、これはどの文献からの引用なのでしょうか。患者さんは術後 NASOX は術前と同様の副作
19