よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※ 2 登録時には造影剤アレルギーを有しなかったが本試験登録後に CT 造影剤アレルギーが生じた場合に
は造影 MRI でも可。腎機能障害、気管支喘息が原因で造影検査自体が不可能となった場合には、単純 CT、
単純 MRI も許容する。
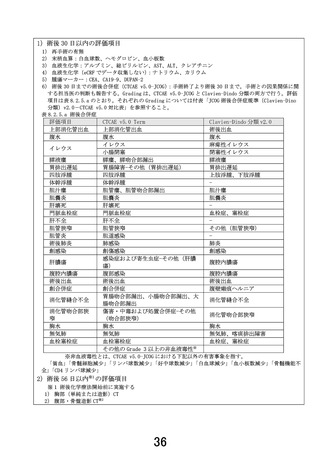
3)術後 90 日以内の評価項目
1) 再手術の有無
術後 90 日までの術後合併症(CTCAE v5.0-JCOG)
:手術終了より術後 90 日まで。手術との因果関係に
関する担当医の判断も報告する。Grading は、CTCAE v5.0-JCOG と Clavien-Dindo 分類の両方で行う。評
価項目は表 8.2.5.a のとおり。それぞれの Grading については付表「JCOG 術後合併症規準(Clavien-Dino
分類)v2.0-CTCAE v5.0 対比表」を参照すること。
術後化学療法中の安全性評価項目
A 群:各コース開始前 7 日以内に以下の項目を評価する。ただし、体重と CCr は第 1 コース開始前のみ評価を
行う。
第 1 コースは 2 週に 1 回以上、第 2 コース以降は 3 週に 1 回以上、プロトコール治療終了まで、以下の
項目を評価する。
安全性評価パート、B 群:各コース開始当日または前日に以下の項目を評価する。ただし、体重と CCr は第 1 コ
ース開始前 7 日以内に評価を行う。
第 1 コースの day 8(±1 日を許容)にも 2)
、3)
、5)
、6)の評価を行う。第 2 コース以降の day 8
の安全性評価は必須としない。
1) 全身状態:PS(ECOG)
、体重(第 1 コース開始前のみ)
2) 末梢血算:白血球数、好中球数(ANC:桿状球数+分節球数)
、ヘモグロビン、血小板数
3) 血液生化学:アルブミン、総ビリルビン、AST、ALT、クレアチニン、ナトリウム、カリウム
4) CCr(Cockcroft-Gault 式による推定値、推定値が 50 mL/min 未満の場合は実測値)(第 1 コース開始前の
み)
Cockcroft-Gault 式
男性:CCr={
(140-年齢)×体重(kg)
}/{72×血清クレアチニン値(mg/dL)
}
女性:CCr=0.85×{
(140-年齢)×体重(kg)
}/{72×血清クレアチニン値(mg/dL)
}
5) 血液生化学(CRF でデータ収集しない):ALP、LDH、CRP
6) 自他覚所見(CTCAE v5.0-JCOG で記載)
・ 血液およびリンパ系障害:発熱性好中球減少症
・ 眼障害:流涙
・ 胃腸障害:口腔粘膜炎、悪心、嘔吐、胃潰瘍、十二指腸潰瘍、便秘、下痢
・ 一般・全身障害および投与部位の状態:発熱、疲労
・ 免疫系障害:アレルギー反応
・ 感染症および寄生虫症:気管支感染、肺感染、上気道感染、カテーテル関連感染、胆道感染、胆嚢感
染、膀胱感染、腎感染、尿路感染、腹膜感染、感染性小腸結腸炎、敗血症
・ 傷害、中毒および処置合併症:吻合部潰瘍、注入に伴う反応(B 群のみ)
・ 代謝および栄養障害:食欲不振、脱水
・ 神経系障害:嗅神経障害、味覚不全、末梢性感覚ニューロパチー、末梢性運動ニューロパチー
・ 呼吸器、胸郭および縦隔障害:肺臓炎
・ 皮膚および皮下組織障害:斑状丘疹状皮疹、手掌・足底発赤知覚不全症候群、蕁麻疹、脱毛症、皮膚色
素過剰
術後化学療法中の有効性評価項目
術後化学療法中には効果判定は行わない。
ただし、術後化学療法開始後 12 週毎(±2 週を許容)に以下の検査を行い、再発の有無について評価する。
再発が認められた場合は、全身状態(PS)および再発形式(局所再発、肝転移、腹膜転移、リンパ節転移、肺転
移、骨転移、その他)を記録する。
1) 胸部(単純または造影)CT
2) 腹部・骨盤造影 CT※
3) 腫瘍マーカー:CEA、CA19-9、DUPAN-2
※ 登録時には造影剤アレルギーを有しなかったが本試験登録後に CT 造影剤アレルギーが生じた場合には造
影 MRI でも可。腎機能障害、気管支喘息が原因で造影検査自体が不可能となった場合には、単純 CT、単純
MRI も許容する。
37
は造影 MRI でも可。腎機能障害、気管支喘息が原因で造影検査自体が不可能となった場合には、単純 CT、
単純 MRI も許容する。
3)術後 90 日以内の評価項目
1) 再手術の有無
術後 90 日までの術後合併症(CTCAE v5.0-JCOG)
:手術終了より術後 90 日まで。手術との因果関係に
関する担当医の判断も報告する。Grading は、CTCAE v5.0-JCOG と Clavien-Dindo 分類の両方で行う。評
価項目は表 8.2.5.a のとおり。それぞれの Grading については付表「JCOG 術後合併症規準(Clavien-Dino
分類)v2.0-CTCAE v5.0 対比表」を参照すること。
術後化学療法中の安全性評価項目
A 群:各コース開始前 7 日以内に以下の項目を評価する。ただし、体重と CCr は第 1 コース開始前のみ評価を
行う。
第 1 コースは 2 週に 1 回以上、第 2 コース以降は 3 週に 1 回以上、プロトコール治療終了まで、以下の
項目を評価する。
安全性評価パート、B 群:各コース開始当日または前日に以下の項目を評価する。ただし、体重と CCr は第 1 コ
ース開始前 7 日以内に評価を行う。
第 1 コースの day 8(±1 日を許容)にも 2)
、3)
、5)
、6)の評価を行う。第 2 コース以降の day 8
の安全性評価は必須としない。
1) 全身状態:PS(ECOG)
、体重(第 1 コース開始前のみ)
2) 末梢血算:白血球数、好中球数(ANC:桿状球数+分節球数)
、ヘモグロビン、血小板数
3) 血液生化学:アルブミン、総ビリルビン、AST、ALT、クレアチニン、ナトリウム、カリウム
4) CCr(Cockcroft-Gault 式による推定値、推定値が 50 mL/min 未満の場合は実測値)(第 1 コース開始前の
み)
Cockcroft-Gault 式
男性:CCr={
(140-年齢)×体重(kg)
}/{72×血清クレアチニン値(mg/dL)
}
女性:CCr=0.85×{
(140-年齢)×体重(kg)
}/{72×血清クレアチニン値(mg/dL)
}
5) 血液生化学(CRF でデータ収集しない):ALP、LDH、CRP
6) 自他覚所見(CTCAE v5.0-JCOG で記載)
・ 血液およびリンパ系障害:発熱性好中球減少症
・ 眼障害:流涙
・ 胃腸障害:口腔粘膜炎、悪心、嘔吐、胃潰瘍、十二指腸潰瘍、便秘、下痢
・ 一般・全身障害および投与部位の状態:発熱、疲労
・ 免疫系障害:アレルギー反応
・ 感染症および寄生虫症:気管支感染、肺感染、上気道感染、カテーテル関連感染、胆道感染、胆嚢感
染、膀胱感染、腎感染、尿路感染、腹膜感染、感染性小腸結腸炎、敗血症
・ 傷害、中毒および処置合併症:吻合部潰瘍、注入に伴う反応(B 群のみ)
・ 代謝および栄養障害:食欲不振、脱水
・ 神経系障害:嗅神経障害、味覚不全、末梢性感覚ニューロパチー、末梢性運動ニューロパチー
・ 呼吸器、胸郭および縦隔障害:肺臓炎
・ 皮膚および皮下組織障害:斑状丘疹状皮疹、手掌・足底発赤知覚不全症候群、蕁麻疹、脱毛症、皮膚色
素過剰
術後化学療法中の有効性評価項目
術後化学療法中には効果判定は行わない。
ただし、術後化学療法開始後 12 週毎(±2 週を許容)に以下の検査を行い、再発の有無について評価する。
再発が認められた場合は、全身状態(PS)および再発形式(局所再発、肝転移、腹膜転移、リンパ節転移、肺転
移、骨転移、その他)を記録する。
1) 胸部(単純または造影)CT
2) 腹部・骨盤造影 CT※
3) 腫瘍マーカー:CEA、CA19-9、DUPAN-2
※ 登録時には造影剤アレルギーを有しなかったが本試験登録後に CT 造影剤アレルギーが生じた場合には造
影 MRI でも可。腎機能障害、気管支喘息が原因で造影検査自体が不可能となった場合には、単純 CT、単純
MRI も許容する。
37