よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
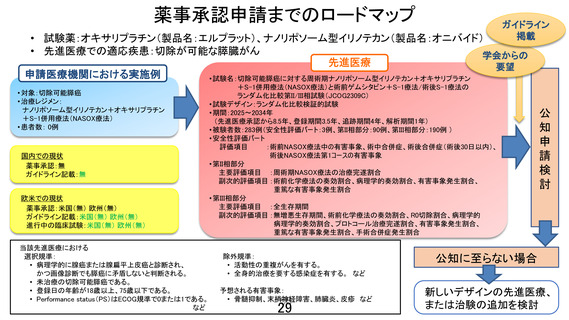
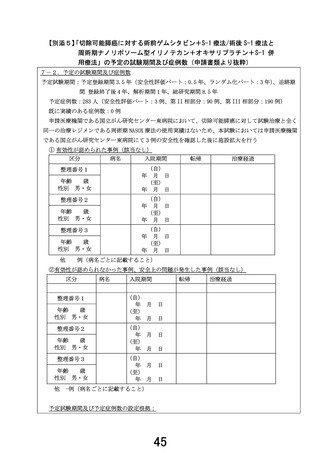
【別添4】
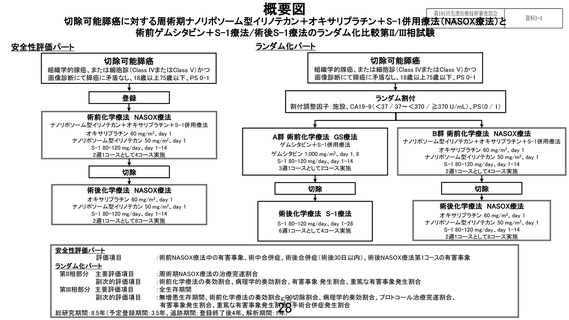
「切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と
周術期ナノリポソーム型イリノテカン+オキサリプラチン+S-1 併
用療法」の有効性及び安全性の評価(申請書類より抜粋)
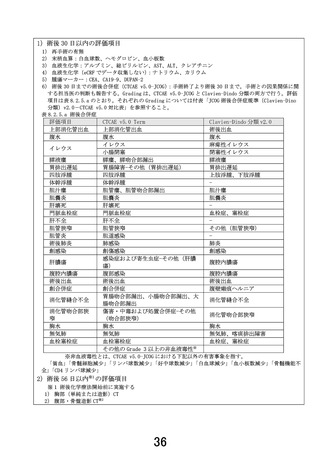
7-1.有効性及び安全性の評価
【安全性評価パート】
評価項目:術前 NASOX 療法中の有害事象、術中合併症、術後合併症(術後 30 日以内)
、術後 NASOX 療
法第 1 コースの有害事象
【ランダム化パート】
第Ⅱ相部分
主要評価項目:周術期 NASOX 療法の治療完遂割合
副次評価項目:術前化学療法の奏効割合、病理学的奏効割合、有害事象発生割合、重篤な有害事象発
生割合
第Ⅲ相部分
主要評価項目:全生存期間
副次評価項目:無増悪生存期間、術前化学療法の奏効割合、R0 切除割合、病理学的奏効割合、プロト
コール治療完遂割合、有害事象発生割合、重篤な有害事象発生割合、手術合併症発生割合
(術中、術後 30 日以内、術後 90 日以内)
治療期間中の検査と評価
以下に示す安全性評価項目の頻度は最低限のものである。これより密な頻度で検査を行うことや、検査
項目を追加することを禁じるものではない。
ただし、有効性評価項目に関しては、頻度を密にすることで有効性評価にバイアスが生じる可能性が高
いことから、増悪が疑われる場合を除いて、規定の頻度で評価を行うこと。規定された時期以外に追加
で行われた検査結果は、増悪の有無の判断には用いるが、効果判定における CR/PR/SD の判定には用いな
い。
術前化学療法中の安全性評価項目
1)術前化学療法中に評価する安全性評価項目
A 群:GEM 投与予定日(2 投 1 休の場合は day 1、day 8)の当日または前日に以下の評価を行う。
休薬日(2 投 1 休の場合は day 15 に相当する日)の安全性評価は必須としない。
安全性評価パート、B 群:コース開始予定日当日または前日に以下の評価を行う。
第 1 コースの day 8(±1 日を許容)にも以下の検査を行う。第 2 コース以降の day 8 の安全性評価は必須と
しない。
1) 末梢血算:白血球数、好中球数(ANC:桿状球数+分節球数)
、ヘモグロビン、血小板数
2) 血液生化学:アルブミン、総ビリルビン、AST、ALT、クレアチニン、ナトリウム、カリウム
3) 血液生化学(eCRF でデータ収集しない)
:ALP、LDH、CRP
4) 自他覚所見(CTCAE v5.0-JCOG で記載)
血液およびリンパ系障害:発熱性好中球減少症
眼障害:流涙
胃腸障害:口腔粘膜炎、悪心、嘔吐、便秘、下痢
一般・全身障害および投与部位の状態:発熱、疲労
免疫系障害:アレルギー反応
感染症および寄生虫症:気管支感染、肺感染、上気道感染、カテーテル関連感染、胆道感染、胆嚢
感染、膀胱感染、腎感染、尿路感染、腹膜感染、感染性小腸結腸炎、敗血症
傷害、中毒および処置合併症:注入に伴う反応
代謝および栄養障害:食欲不振
神経系障害:嗅神経障害、味覚不全、末梢性感覚ニューロパチー、末梢性運動ニューロパチー
呼吸器、胸郭および縦隔障害:肺臓炎
皮膚および皮下組織障害:斑状丘疹状皮疹、手掌・足底発赤知覚不全症候群、蕁麻疹、脱毛症、皮
膚色素過剰
34
「切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と
周術期ナノリポソーム型イリノテカン+オキサリプラチン+S-1 併
用療法」の有効性及び安全性の評価(申請書類より抜粋)
7-1.有効性及び安全性の評価
【安全性評価パート】
評価項目:術前 NASOX 療法中の有害事象、術中合併症、術後合併症(術後 30 日以内)
、術後 NASOX 療
法第 1 コースの有害事象
【ランダム化パート】
第Ⅱ相部分
主要評価項目:周術期 NASOX 療法の治療完遂割合
副次評価項目:術前化学療法の奏効割合、病理学的奏効割合、有害事象発生割合、重篤な有害事象発
生割合
第Ⅲ相部分
主要評価項目:全生存期間
副次評価項目:無増悪生存期間、術前化学療法の奏効割合、R0 切除割合、病理学的奏効割合、プロト
コール治療完遂割合、有害事象発生割合、重篤な有害事象発生割合、手術合併症発生割合
(術中、術後 30 日以内、術後 90 日以内)
治療期間中の検査と評価
以下に示す安全性評価項目の頻度は最低限のものである。これより密な頻度で検査を行うことや、検査
項目を追加することを禁じるものではない。
ただし、有効性評価項目に関しては、頻度を密にすることで有効性評価にバイアスが生じる可能性が高
いことから、増悪が疑われる場合を除いて、規定の頻度で評価を行うこと。規定された時期以外に追加
で行われた検査結果は、増悪の有無の判断には用いるが、効果判定における CR/PR/SD の判定には用いな
い。
術前化学療法中の安全性評価項目
1)術前化学療法中に評価する安全性評価項目
A 群:GEM 投与予定日(2 投 1 休の場合は day 1、day 8)の当日または前日に以下の評価を行う。
休薬日(2 投 1 休の場合は day 15 に相当する日)の安全性評価は必須としない。
安全性評価パート、B 群:コース開始予定日当日または前日に以下の評価を行う。
第 1 コースの day 8(±1 日を許容)にも以下の検査を行う。第 2 コース以降の day 8 の安全性評価は必須と
しない。
1) 末梢血算:白血球数、好中球数(ANC:桿状球数+分節球数)
、ヘモグロビン、血小板数
2) 血液生化学:アルブミン、総ビリルビン、AST、ALT、クレアチニン、ナトリウム、カリウム
3) 血液生化学(eCRF でデータ収集しない)
:ALP、LDH、CRP
4) 自他覚所見(CTCAE v5.0-JCOG で記載)
血液およびリンパ系障害:発熱性好中球減少症
眼障害:流涙
胃腸障害:口腔粘膜炎、悪心、嘔吐、便秘、下痢
一般・全身障害および投与部位の状態:発熱、疲労
免疫系障害:アレルギー反応
感染症および寄生虫症:気管支感染、肺感染、上気道感染、カテーテル関連感染、胆道感染、胆嚢
感染、膀胱感染、腎感染、尿路感染、腹膜感染、感染性小腸結腸炎、敗血症
傷害、中毒および処置合併症:注入に伴う反応
代謝および栄養障害:食欲不振
神経系障害:嗅神経障害、味覚不全、末梢性感覚ニューロパチー、末梢性運動ニューロパチー
呼吸器、胸郭および縦隔障害:肺臓炎
皮膚および皮下組織障害:斑状丘疹状皮疹、手掌・足底発赤知覚不全症候群、蕁麻疹、脱毛症、皮
膚色素過剰
34